️ Đánh giá tính an toàn của vaccine (P2)
.png)
Sinh viên ĐHYD Châu Hào Nam
Lưu Tuyết Hoa
Đặng Văn Vương
Trần Phương Nam
Lê Trần Phương Uyên
ThS. Đỗ Đăng Trí
Phê duyệt, cấp phép và sản xuất vaccine
Khi một loại vaccine đã trải qua giai đoạn thử nghiệm lâm sàng, chúng sẽ được các cơ quan quản lý liên quan đánh giá sự tuân thử các tiêu chí về chất lượng, độ an toàn và hiệu quả. Sau khi được phê duyệt, các nhà sản xuất có thể gửi vaccine cho WHO để tham gia sơ tuyển, xét duyệt để cấp phép sản xuất. Tại đây, quy trình đánh giá đảm bảo chất lượng, an toàn và hiệu quả của vaccine được thực hiện, đồng thời giúp Liên hợp quốc và các tổ chức đấu thầu quốc tế xác định tính phù hợp của vaccine đối với các chương trình tiêm chủng.
Sau khi được cấp phép, quy mô của sản xuất vaccine bắt đầu được mở rộng. Chất lượng của vaccine được đảm bảo thông qua hệ thống giám sát quá trình sản xuất Good manufacturing practices (GMP)7. GMP bao gồm các tiêu chuẩn ở tất cả khía cạnh trong sản xuất, từ nguyên liệu ban đầu, cơ sở, trang thiết bị đến việc đào tạo và tuân thủ vệ sinh của nhân viên. Vaccine sau khi được sản xuất ra được lưu giữ trong lọ thủy tinh giúp tăng khả năng chịu nhiệt, giảm thiểu các rủi ro liên quan tới việc vận chuyển. Qúa trình bảo quản vaccine được thực hiện nghiêm ngặt trong các tủ lạnh y tế chuyên dụng. Đa số các loại vaccine được bảo quản ở nhiệt độ từ 2 – 80C nhằm duy trì tính an toàn và hiệu quả của vaccine. Một số loại vaccine yêu cầu nhiệt độ bảo quản lên đến -200C và có thể -700C.
Để vận chuyển đến nhiều nơi trên thế giới, vaccine phải được vận chuyển bằng các thiết bị chuyên dụng nhằm tránh tác động lên tính toàn vẹn của vaccine. Quá trình vận chuyển bắt đầu từ các máy bay có kho lạnh chuyên dụng tới các xe tải lạnh giúp phân phối vaccine tới các khu vực cụ thể. Tại đây, chúng được bảo quản trong tủ lạnh và cuối cùng được phân phối tới các địa điểm tiêm chủng bằng thùng đá xách tay. Vaccine khi mở hộp sẽ phải được tiêm trong khoảng thời gian tối đa cho phép từ 6-12h tùy thuộc loại vaccine. Tất cả các giai đoạn đều được giám sát chặt chẽ, hạn chế những thay đổi liên quan tới chất lượng của vaccine.
Đánh giá tính an toàn sau khi được cấp phép sử dụng trên dân số chung
An toàn vaccine là rất quan trọng, do đó sau khi sản phẩm vaccine đã được cấp phép và đưa vào sử dụng trong cộng đồng, thử nghiệm lâm sàng giai đoạn IV và cảnh giác dược tiếp tục được tiến hành nhằm đánh giá chất lượng và tác động thực sự của vaccine lên người được tiêm chủng. Qúa trình này đánh giá tác động của vaccine lên các nhóm dân số không hiện diện ở các thử nghiệm lâm sàng (người có bệnh lý tiềm ẩn, trẻ sinh non,..); phát hiện các tác dụng phụ hiếm gặp, nghiêm trọng, tác dụng phụ khởi phát chậm có thể không phát hiện được trước thời điểm vaccine được cấp phép.
Hệ thống giám sát an toàn vaccine (AEFI – Adverse Events Following Immunization) được thiết kế để thu thập các biến cố bất lợi liên quan đến việc sử dụng vaccine. Các biến cố này được đánh giá bởi các chuyên gia y tế, sau đó được báo cáo cho cơ quan quản lý quốc gia (NRA – National Regulatory authorities) hoặc cơ quan có thẩm quyền thích hợp. Ở mỗi quốc gia, việc giám sát tính an toàn của vaccine còn đòi hỏi sự tham gia của cả Chương trình Tiêm chủng quốc gia (NIP – National Immunization Programme) và Trung tâm cảnh giác dược quốc gia (NPC – National Pharmacovigilance Center). Các mục tiêu chính của một hệ thống giám sát AEFI hiệu quả bao gồm:
- Xác định các vấn đề với các lô hàng, nhãn hiệu của loại vaccine dẫn đến tác các dụng phụ ghi nhận
- Phát hiện, ngăn ngừa các lỗi liên quan tới quá trình chuẩn bị, xử lý, bảo quản và sử dụng vaccine
- Giảm thiểu sự nhầm lẫn phát sinh từ các sự kiện bất lợi ngẫu nhiên sau tiêm chủng như lo lắng, sợ tiêm bằng cách giáo dục, trấn an người đi tiêm chủng về tính an toàn của vaccine.
- Cung cấp các thông tin đầy đủ về mối quan tâm tới vaccine của người dân, giúp họ nâng cao nhận thức về tính an toàn của vaccine.
- Đưa ra các giả thuyết mới về tác dụng phụ của vaccine đặc trưng cho từng dân số quốc gia/ khu vực.
- Ước tính tỉ lệ xuất hiện của các biến cố bất lợi trong dân số chung, so sánh với dữ liệu từ các cuộc thử nghiệm.
Các tác dụng bất lợi của vaccine được thu thấp thông qua hệ thống giám sát thụ động và chủ động. Ở hệ thống giám sát thụ động, các dữ liệu báo cáo được cung cấp từ các nhà cung cấp dịch vụ chăm sóc sức khỏe và từ chính những người tham gia tiêm chủng một cách tự nguyện, tương đối dễ thực hiện và tiết kiệm chi phí. Hệ thống này không chủ động tìm kiếm, thu thập dữ liệu hoặc đo lường kết quả bằng cách sử dụng các đề cương nghiên cứu.
Ngược lại, hệ thống giám sát chủ động được thực hiện thông qua các thử nghiệm lâm sàng giai đoạn IV. Các thử nghiệm lâm sàng giúp đánh giá tác động của những thay đổi trong công thức vaccine, chủng vaccine, tuổi tiêm chủng, số lượng và khoảng cách liều vaccine, tiêm đồng thời và khả năng thay thế vaccine từ các nhà sản xuất khác nhau về tính an toàn và khả năng sinh miễn dịch. Một số vaccine được cấp phép gần đây đã trải qua các thử nghiệm giai đoạn IV với số lượng lên tới 100.000 người và kéo dài từ 4 đến 6 năm. Các trung tâm lâm sàng lớn cũng được sử dụng để thực hiện nghiên cứu về các nguy cơ sức khỏe liên quan đến việc tiêm chủng, một ví dụ trong số đó là Mạng lưới đánh giá an toàn tiêm chủng lâm sàng của Mỹ (CISA – USA’s Clinical Immunization Safety Assessment).
Đánh giá sự liên quan của các sự kiện bất lợi được báo cáo và vaccine
Quá trình chính thức để đánh giá mối quan hệ nhân quả của một sự kiện bất lợi và một sự phơi nhiễm (ví dụ, vaccine) là một quá trình phức tạp có thể được coi là câu trả lời cho ba câu hỏi: Can it? Did it? Will it?
Đối với các báo cáo một ca, câu hỏi “Did it?” thường được trả lời hơn. Nếu câu trả lời là có, thì “Can!” cũng được trả lời trong khẳng định. Đương nhiên, người ta nghi ngờ vaccine là nguyên nhân khi một tác dụng phụ xảy ra sau khi tiêm chủng, nhưng trên thực tế, mối liên hệ nhân quả có thể tồn tại hoặc có thể không. Thông tin được sử dụng để đánh giá quan hệ nhân quả trong các báo cáo này bao gồm những điều sau đây:
- Kinh nghiệm chung về vaccine trước đây
- Các nguyên nhân thay thế
- Tính nhạy cảm của người được chủng ngừa
- Thời gian của các sự kiện
- Đặc điểm của sự kiện
- Ngừng sử dụng
- Sử dụng lại sau đó
Khi một loại vaccine có thể gây ra một biến cố bất lợi, câu hỏi “Will it?” đề cập đến xác suất mà một cá nhân sẽ mắc phải hoặc, đối với quần thể, tỷ lệ mắc phải (tức là rủi ro có thể xảy ra). Những dữ liệu này rất quan trọng cho việc cân nhắc rủi ro và thường chỉ có sẵn khi câu hỏi “Can it?” được trả lời dựa trên các nghiên cứu dịch tễ học.
Một cách tiếp cận khác để giảm thiểu tranh cãi là giả định rằng các sự kiện bất lợi xảy ra trong một khoảng thời gian cụ thể sau khi tiêm chủng là do vaccine gây ra, bất kể chúng thực sự là nhân quả hay chỉ là ngẫu nhiên. Cách tiếp cận quan hệ nhân quả này được sử dụng trong một số chương trình bồi thường thương tật do vaccine để đơn giản hóa thủ tục. Các phân loại dựa trên các triệu chứng được báo cáo, khoảng thời gian từ khi tiêm chủng đến khi bắt đầu các đợt điều trị, và một tập hợp các định nghĩa trường hợp.
Thông thường, mối liên hệ nhân quả giữa vaccine và một biến cố bất lợi có thể được thiết lập nếu có một kết quả chẩn đoán duy nhất trong phòng thí nghiệm (ví dụ: nuôi cấy vi rút ở bệnh nhân có biến cố bất lợi và giải trình tự gen cho thấy vi rút là vaccine chứ không phải chủng hoang dã); hội chứng lâm sàng duy nhất (ví dụ: bệnh bại liệt cấp tính cổ điển đối với bệnh bại liệt xảy ra ngay sau khi nhận vaccine bại liệt uống ở nơi không có khả năng lưu hành vi rút bại liệt hoang dã); hoặc một nghiên cứu dịch tễ học cho thấy những người được tiêm chủng có nhiều nguy cơ gặp phải tác dụng phụ hơn những người không được tiêm chủng. Thật không may, rất ít báo cáo VAERS đáp ứng một trong hai tiêu chí đầu tiên. Vì các báo cáo của Hệ thống báo cáo sự kiện bất lợi của vắc-xin (Vaccine Adverse Event Reporting Systems –VAERS) chỉ đến từ những người được tiêm chủng với các tác dụng phụ nên chúng chỉ đại diện cho ô “a” của bảng “2 x 2” cần thiết cho một nghiên cứu dịch tễ học (Hình 2).
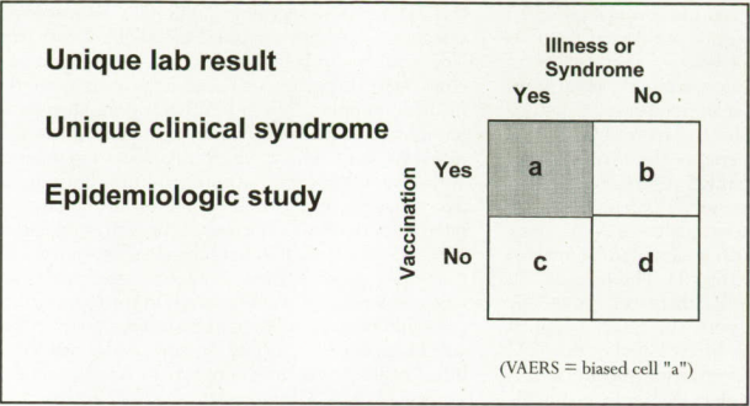
Hình 2. Thiết lập mối liên hệ nhân quả: sự kiện bất lợi và vaccine
Kết luận
Vaccine là một chìa khóa quan trọng để ngăn chặn các đại dịch xảy ra. Giống như tất cả các loại thuốc, mọi loại vaccine đều cần phải trải qua quá trình thử nghiệm rộng rãi và nghiêm ngặt trước khi có thể được sử dụng rộng rãi cho người dân. Thêm vào đó, khi vaccine được sử dụng, chúng vẫn phải được giám sát liên tục để đảm bảo an toàn cho người được tiêm chủng, củng cố niềm tin của cộng đồng để tiến tới đẩy lùi các đại dịch.
Tài liệu tham khảo
1. Chen RT, Hibbs B. Vaccine safety: current and future challenges. Pediatric annals. Jul 1998;27(7):445-55. doi:10.3928/0090-4481-19980701-11
2. Research USDoHaHSFaDACfBEa. Development and Licensure of Vaccines to Prevent COVID-19 | Guidance for Industry. https://www.fda.gov/media/139638/download
3. Shan Su LD, and Shibo Jiang. Learning from the past: development of safe and effective COVID-19 vaccines. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7566580/?fbclid=IwAR2PnwbMFyulmt7RNPxFMwFa0zPTk0GGvFOMn9Sy_-jNL1AahkMmQXnSVZI
4. Singh K, Mehta S. The clinical development process for a novel preventive vaccine: An overview. Journal of postgraduate medicine. Jan-Mar 2016;62(1):4-11. doi:10.4103/0022-3859.173187
5. WHO. How are vaccines developed? WHO’s Vaccines Explained series. 8 December 2020. https://wwwwhoint/news-room/feature-stories/detail/how-are-vaccines-developed.
6. WHO. Manufacturing, safety and quality control of vaccines, WHO’s Vaccines Explained series. https://wwwwhoint/news-room/feature-stories/detail/manufacturing-safety-and-quality-control. 8 December 2020;
7. WHO. Medicines: Good manufacturing practices. https://wwwwhoint/news-room/q-a-detail/medicines-good-manufacturing-processes. 20 November 2015
8. WHO. Vaccine safety basics.E-elearning course: Module 1. Introduction to vaccine safety. https://vaccine-safety-trainingorg/post-licensure-vaccine-safetyhtml.
.png)
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









