️ Katetra (Lopinavir + Ritonavir) - USA (Phần 3)
DƯỢC ĐỘNG HỌC
Các đặc tính dược động học của lopinavir khi dùng cùng với ritonavir đã được đánh giá ở những người lớn tình nguyện khỏe mạnh và ở bệnh nhân nhiễm HIV; không quan sát thấy có sự khác biệt giữa hai nhóm. Về cơ bản, lopinavir dược chuyển hóa hoàn toàn qua CYP3A. Ritonavir ức chế quá trình chuyển hóa của lopinavir, do đó làm tăng nồng độ lopinavir trong huyết tương. Qua các nghiên cứu, dùng Kaletra 400/100 mg, 2 lần/ngày nồng độ trung bình của lopinavir trong huyết tương ở trạng thái ổn định cao gấp 15-20 lần so với ritonavir ở bệnh nhân nhiễm HIV. Nồng độ ritonavir trong huyết tương ít hơn 7% so với nồng độ có được sau khi dùng ritonavir liều 600 mg, 2 lần/ngày. Trỉ số EC50 kháng virus của lopinavir trên in vitro thấp hơn của ritonavir khoảng 10 lần. Do do, hoạt tính kháng virus của Kaletra là do lopinavir.
Hình 1 biểu diễn nồng độ trung bình trong huyết tương ở trạng thái ổn định của lopinavir và ritonavir sau khi dùng Kaletra liều 400/100 mg 2 lần/ngày cùng với thức ăn trong 3 tuần từ một nghiên cứu dược động học ở bệnh nhân người lớn nhiễm HIV (n=19).
Hình 1. Nồng độ trung bình trong huyết tương ở trạng thái ổn định với khoảng tin cậy (Cl) 95% ở các bệnh nhân người lớn nhiễm HIV (n=19).
+ Hấp thu
Trong một nghiên cứu dược động học ở các bệnh nhân nhiễm HIV (n=19), dùng đa liều Kaletra 400/100 mg 2 lần/ngày cùng với thức ăn trong 3 tuần cho thấy nồng độ đỉnh trong huyết tương (Cmax) trung bình + SD của lopinavir là 9,8 ± 3,7 mcg/ml, đạt được khoảng 4 giờ sau khi dùng. Nồng độ trung bình ở phần thấp nhất của đường cong trạng thái ổn định trước khi dùng liều buổi sáng là 7,1 ± 2.9 mcg/ml và nồng độ tối thiểu trong một khoảng liều là 5,5 ± 2/7 mcg/ml. AUC của lopinavir sau khoảng thời gian dùng 12 giờ là 92,6 ± 36,7 mcg*giờ/ml. Sinh khả dụng tuyệt đối của lopinavir khi dùng cùng lúc với ritonavir ở người chưa được thiết lập. Trong điều kiện không ăn kiêng (500kcal, 25% chất béo), nồng độ lopinavir tương tự sau khi dùng Kaletra với các dạng viên nang và dung dịch.
Trong điều kiện ăn kiêng, cả AUC và Cmax trung bình của lopinavir khi dùng Kaletra dạng dung dịch thấp hơn 22% so với dạng viên nang.
Nồng độ lopinavir và ritonavir trong huyết tương sau khi dùng 2 viên nén Kaletra 200/50 mg là tương đương với 3 viên nang Kaletra 133,3/33,3mg với chế độ ăn ít ảnh hưởng đến dược động học.
+ Ảnh hưởng của thức ăn lên sự hấp thu khi dùng đường uống
Kaletra dạng viên nang mềm và dung địch có tính tương đương sinh học trong những điều kiện không ăn kiêng (thức ăn có lượng chất béo vừa phải). Dùng Kaletra viên nang mềm liều duy nhất 400/100 mg với chế độ ăn chất béo vừa phải ( 500-682 kcal, 23-25% calo từ chất béo) làm tăng AUC và Cmax của lopinavir lên trung bình 48% và 23% khi so sánh với chế độ ăn kiêng. Đối với Kaletra dung dịch uống, tăng tương ứng AUC và Cmax của lopinavir là 80% và 54%. So sánh với chế độ ăn kiêng, dùng Kaletra với chế độ ăn nhiều chất béo (872 kcal, 56% từ chất béo) làm tăng AUC và Cmax lopinavir lên khoảng 97% và 43% đối với viên nang mềm; 130% và 56% đối với dung dịch uống. Để làm tăng tính khả dụng sinh học và giảm thiểu tính biến đối về dược động học nên dùng Kaletra với thức ăn.
+ Phân bố
Ở trạng thái ổn định khoảng 98-99% lopinavir gắn kết với protein huyết tương. Lopinavir gan với cả alpha- I-acid glycoprotein (AAG) và albumin; tuy nhiên, thuốc có ái lực cao hơn đối với AAG. Ở trạng thái ổn định, sự gắn kết lopinavir với protein vẫn hằng định ở nồng độ quan sát được sau khi dùng Kaletra 400/100 mg 2 lần/ngày, giống nhau ở người tình nguyện khoẻ mạnh và bệnh nhân bị nhiễm HIV.
+ Chuyển hóa
Các thí nghiệm in vitro với microsom gan người cho thấy rằng lopinavir chủ yếu qua con đường chuyển hóa oxy hóa. Lopinavir được chuyển hoá chủ yếu bởi hệ thống cytochrom P450 ở gan, hầu như hoàn toàn qua CYP3A isozym. Ritonavir là một chất ức chế CYP3A mạnh, nó ức chế sự chuyển hoá của lopinavir và do đó làm tăng nồng độ lopinavir trong huyết tương. Nghiên cứu lopinavir bằng chất đồng vị phóng xạ 14C ở người cho thấy 89% hoạt tính phóng xạ trong huyết tương sau khi dùng liều đơn 400/100 mg Kaletra là do thuốc gốc. Ít nhất có 13 chất chuyến hoá oxy hóa của lopinavir đã được xác định ở người. Ritonavir gây kích ứng các enzym chuyển hóa, dẫn đến kích ứng chuyển hóa chính nó. Nồng độ lopinavir trước khi dùng liều tiếp theo giảm theo thời gian khi dùng nhiều liều, ổn định sau khoảng 10-16 ngày.
+ Thải trừ
Sau khi dùng 14C-lopinavir/ritonavir liều 400/100 mg, khoảng 10,4 ± 2,3% và 82,6 ± 2,5% liều 14C lopinavir có thể tìm thấy trong nước tiểu và phân sau 8 ngày, một cách tương ứng. Lopinavir dạng không chuyển hóa chiếm khoảng 2,2% và 19,8% của liều dùng tương ứng trong nước tiểu và phân. Sau khi dùng nhiều liều, dưới 3% cùa liều Lopinavir bị đào thải ở dạng không đổi qua nước tiểu.
Độ thanh thải biểu kiến (CL/F) của lopinavir dạng uống là 5,98 ± 5,75 L/giờ (giá trị trung bình ± SD, n=19).
+ Liều dùng ngày một lần
Dược động học cùa Kaletra dùng 1 lần/ngày dược nghiên cứu ở bệnh nhân nhiễm HIV chưa điều trị thuốc kháng virus. Kaletra 800/200mg dùng cùng với emtricitabin 200mg và tenofovir DF 300mg là một phần của phác đồ dùng một lần trong ngày. Dùng nhiều liều Kaletra 800/200mg 1 lần/ngày trong 4 tuần cùng với thức ăn (n=24) tạo ra nồng độ đỉnh trong huyết tương (Cmax) trung bình ± SD của lopinavir là 11,8 ± 3,7 mcg/ml, đạt được khoảng 6 giờ sau khi dùng. Nồng độ trung bình phần thấp nhất của đường cong ở trạng thái ổn định trước khi dùng liều buổi sáng là 3,2 ± 2,1 mcg/ml và nồng độ tối thiểu trong khoảng thời gian liều dùng là 1,7 ± 1.6 mcg/ml. AUC của lopinavir sau khoảng thời gian dùng 24 giờ là 154,1 ± 61,4 mcg*h/ml.
Dược động học cua Kaletra cùng được đánh giá trong sử dụng cho bệnh nhân nhiễm HIV-1 đã từng được điều trị. Sự thể hiện của Lopinavir (Cmax, AUC0-24, Ctrough) với phác đồ Kaletra sử dụng 1 lần/ngày cho bệnh nhân đã từng được điều trị, so với phác đồ dùng 1 lần/ngày trên bệnh nhân chưa từng điều trị.
+ Ảnh hưởng lên điện tâm đồ
Khoảng QTcF được đánh giá trong một nghiên cứu ngẫu nhiên, kiểm chứng chéo với giả dược và kiểm chứng chủ động (moxifloxacin 400 mg, 1 lần/ngày) trên 39 người lớn khỏe mạnh, với 10 lần đo trong khoảng 12 giờ vào ngày thứ 3. Sự khác biệt tối đa trung bình (giới hạn trên khoảng tin cậy 95%) của QTeF so với giả dược là 5.3 (8,1) msec đối với lopinavir/ritonavir 400/100 mg, 2 lần/ngày và 15,2(18,0) msec đối với lopinavir/ritonavir 800/200 mg, 2 lần/ngày. Kaletra 800/200mg, 2 lần/ngày có kết quả ở ngày thứ 3, Cmax trung bình cao gấp khoảng 2 lần Cmax quan sát được ở phác đồ liều 1 lần/ngày hoặc 2 lần/ngày ở trạng thái ổn định đã được duyệt.
Kéo dài khoảng PR cũng được ghi nhận trên những bệnh nhân dùng Kaletra trong cùng một nghiên cứu vào ngày thứ 3. Sự khác biệt tối đa trung bình (giới hạn trên khoảng tin cậy 95%) của kéo dài khoảng PR so với giả được là 24,9 (21,5; 28.3) msec đối với lopinavir/ritonavir 400/100 mg, 2 lần/ngày và 31,9 (28,5; 35,3) msec đối với lopinavir/ritonavir 800/200 mg, 2 lần/ngày (xem phần Cảnh báo và Thận trọng)
Các nhóm bệnh nhân đặc biệt
+ Giới tính, chủng tộc và tuổi
Không quan sát thấy có khác biệt dược động học nào liên quan đến giới tính ở bệnh nhân người lớn. Không quan sát thấy có khác biệt dược động học quan trọng trên lâm sàng nào liên quan đến chủng tộc. Dược động học của lopinavir chưa được nghiên cứu trên bệnh nhận lớn tuổi.
+ Bệnh nhân nhi
Dược động học cua Kaletra 300/75 mg/m, 2 lần/ngày và 230/57,5 mg/m2 2 lần/ngày đã được nghiên cứu trên tổng số 53 bệnh nhân trong nghiên cứu 940, bệnh nhi có độ tuổi từ 6 tháng đến 12 tuổi. Phác đồ 230/57,5 mg/m2 2 lần/ ngày không có nevirapin và 300/75 mg/m2 2 lần/ngày có nevirapin ở bệnh nhi cho thấy nồng độ lopinavir trong huyết tương cũng giống như ở bệnh nhân người lớn dùng, phác đồ 400/100mg 2 lần/ngày (không có nevirapin), trị số AUC, Cmax, và Cmin trung bình của lopinavir ở trạng thái ổn định tương ứng là 72,6 ± 31.1 mcg*h/ml; 8,2 ±2,9 và 3,4 ± 2.1 mcg/ml sau khi dùng Kaletra 230/57,5 mg/m2 2 lần/ngày không có nevirapin (n= 12) và tương ứng là 85,8 ± 36.9 mcg*h/ml: 10.0 ± 3.3 và 3,6 ± 3,5 mcg /ml sau khi dùng Kaletra 300/75 mg/m2 2 lần/ngày có nevirapin (n=12). Phác đồ nevirapin là 7mg/kg 2 lần/ngày (từ 6 tháng đến 8 tuổi) hoặc 4 mg/kg 2 lần/ngày (> 8 tuổi).
Dược động học của dung dịch uống Kaletra khoảng 300/75 mg/m2, 2 lần/ngày cũng đã được đánh giá trên trẻ khoảng 6 tuần tuổi (n=9) và từ 6 tuần tới 6 tháng tuổi (n=18) trong nghiên cứu 1030. Trị số AUC12 , Cmax và C12; trung bình của lopinavir ở trạng thái ổn định tương ứng là 43.4 ± 14,8 mcg*h/ml; 5,2 ± 1,8 và 1,9 ± 1,1 mcg /ml ở trẻ khoảng 6 tuần tuổi và tương ứng là 74,5 ± 37.9 mcg*h/ml; 9.4 ± 4.9 và 3,1 ± 1,8 mcg/ml ở trẻ từ 6 tuần tới 6 tháng tuổi sau khi sử dụng dung dịch uống Kaletra với liều khoảng 300/75 mg/m2. 2 lần/ngày, không dùng phối hợp điều trị NNRTI.
Dược động học của dung dịch uống Kaletra và viên nang Kaletra (Nhóm 1: 400/100 mg/m2, 2 lần/ngày +2 NRTIs; Nhóm 2: 480/120 mg/m2, 2 lần/ngày + ≥ 1 NRTI + 1 NNRTI) đã dược đánh giá trên bệnh nhi và trẻ vị thành niên từ 2 tới 18 tuổi, các bệnh nhi này đã không điều trị thành công trong điều trị trước đó (n=26) trong nghiên cứu 1038. Liều Kaletra 400/100 và 480/120 mg/m2 có kết quả thể hiện lopinavir cao, vì phần lớn bệnh nhân có AUC12 của lopinavir trên 100 mcg*h/ml; cả hai nhóm đối tượng nghiên cứu cũng đạt được nồng độ lopinavir trung bình tối thiểu cao. Chưa có đánh giá về Kaletra phác đồ 1 lần/ngày trên bệnh nhân nhi.
+ Suy thận
Dược động học của lopinavir trên bệnh nhân suy thận chưa được nghiên cứu; tuy nhiên do độ thanh thải qua thận cuả lopinavir là không đáng kể nên giảm độ thanh thải toàn thân là không đáng kể ở bệnh nhân suy thận.
+ Suy gan
Lopinavir chủ yếu bị chuyển hóa và đào thải bởi gan. Dùng nhiều liều lopinavirritonavir 400/100mg 2 lần/ngày ở bệnh nhân đồng nhiễm HIV và HCV bị suy gan từ nhẹ đến trung bình (n=12) thì AUC của lopinavir tăng 30% và Cmax tăng 20% so với bệnh nhân nhiễm HIV có chức năng gan bình thường. Hơn nữa, sự kết gắn protein huyết tương của lopinavir ở người suy gan nhẹ và trung bình thấp hơn so với nhóm chứng (99,09 so với 99,31%). Cẩn trọng khi sử dụng Kaletra cho bệnh nhân suy gan. Kaletra chưa được nghiên cứu trên bệnh nhân suy gan nặng (xem phần Cảnh báo và Thận trọng).
+ Tương tác giữa các thuốc
Trên in vitro, Kaletra là thuốc ức chế P450 isoform CYP3A. Sử dụng đồng thời Kaletra và các thuốc chuyển hóa ban đầu bởi CYP3A có thể làm tăng nồng độ huyết thanh của các thuốc, dẫn tới có thể làm tăng hoặc kéo dài hiệu lực điều trị và tác dụng không mong muốn của các thuốc này (xem phần Chống chỉ định và Tương tác thuốc).
Kaletra không ức chế CYP2D6, CYP2C9, CYP2C19, CYP2EI, CYP2B6 hoặc CYP1A2 ở các nồng độ tương ứng với điều trị lâm sàng.
Trên in vivo. Kaletra cho thấy gây kích ứng chuyển hóa chính nó và làm tăng sự chuyển dạng sinh học của một số thuốc được chuyển hóa qua các men cytochrom P450 và quá quá trình glucuronyl hóa.
Kaletra được chuyển hóa bởi CYP3A. Các thuốc gây kích ứng hoạt tính CYP3A làm tăng độ thanh thải lopinavir, kết quả là làm giảm nồng độ lopinavir huyết tương. Mặc dù chưa thấy có vấn đề gì khi dùng cùng với ketoconazol, dùng Kaletra cùng lúc với các thuốc khác ức chế CYP3A có thể làm tăng nồng độ lopinavir trong huyết tương.
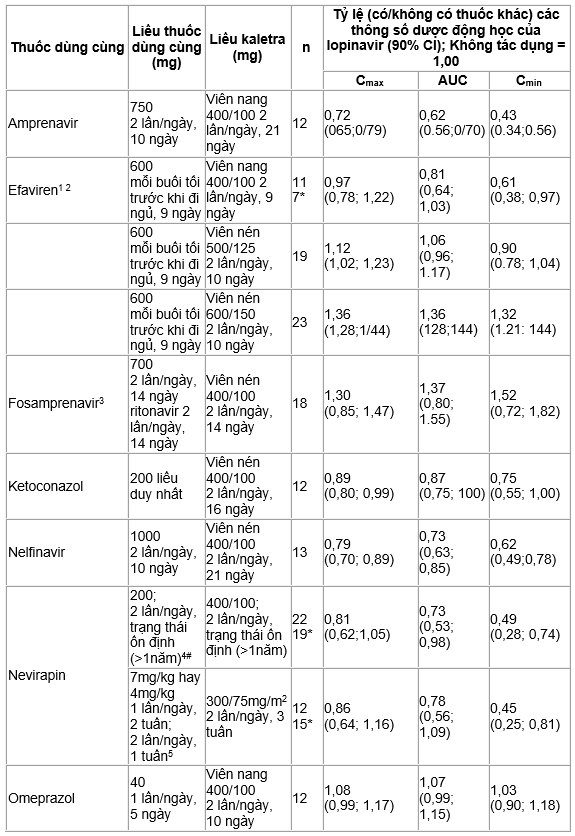
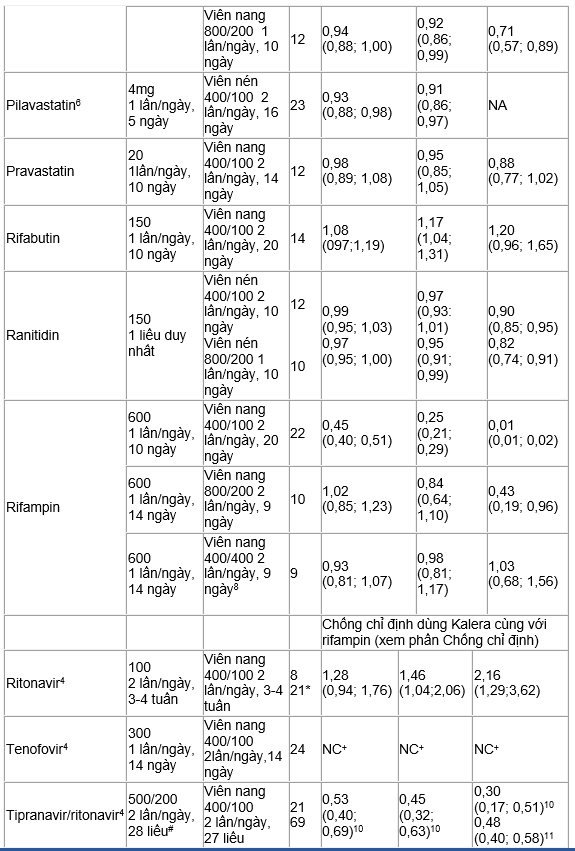
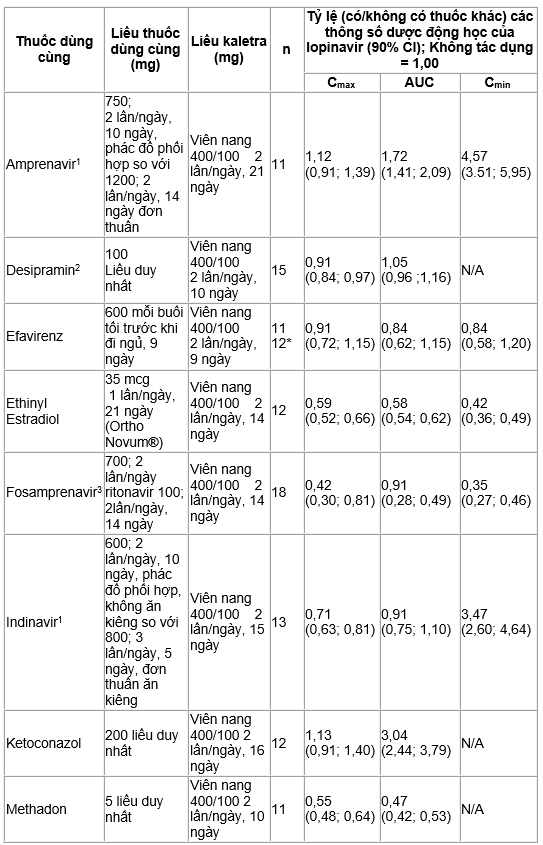
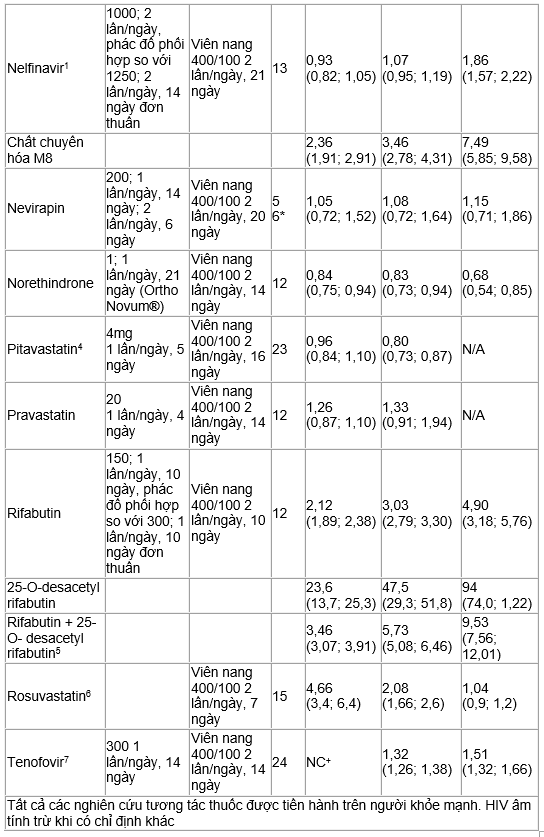
Các nghiên cứu tương tác thuốc được tiến hành với Kaletra và các thuốc khác có thể dùng với nhau và một số thuốc thường được dùng để thử tương tác dược động học. Tác động của việc dùng cùng lúc với Kaletra lên AUC, Cmax và Cmin; được tóm tắt ở Bảng 8 (Tác dụng của các thuốc khác lên lopinavir) và Bảng 9 (Tác dụng của Kaletra lên các thuốc khác). Ảnh hưởng cuả các thuốc khác lên ritonavir không được đưa ra vì nói chung chúng tương quan với các điều được quan sát thấy với lopinavir (nếu nồng, độ lopinavir giảm, nồng độ ritonavir cũng giảm), trừ khi sự khác biệt được ghi chú phía dưới bảng. Các thông tin liên quan đến khuyến cáo lâm sàng xin xem trong phần Tương tác thuốc.
Bảng 8. Tương tác thuốc: Các thông số dược động học đối với lopinavir khi có mặt các thuốc khác dùng cùng lúc về các khuyến cáo liều dùng hay liều lượng thay thế

Bảng 9. Tương tác thuốc: Các thông số được động học đối với thuốc dùng đồng thời khi có mặt Kaletra về các khuyến cáo liều dùng hay liều lượng thay thế.

DƯỢC LỰC HỌC
+ Cơ chế tác dụng
Lopinavir là một chất ức chế HIV protease giúp ngăn chặn sự chia tách của Gag-Pol polyprotein dẫn đến việc tạo ra các virus chưa trưởng thành, không gây nhiễm được.
+ Hoạt tính kháng virus trên in vitro
Hoạt tính kháng virus in vitro của lopinavir chống lại các chủng HIV trong phòng thí nghiệm và các chúng phân lập được trên lâm sàng được đánh giá ở các dòng nguyên bảo lymphô và ở tế bào lymphô máu ngoại vi được gây nhiễm cấp tính. Khi không có huyệt thanh người, nồng độ có tác dụng 50% (ECso) trung bình cuả lopinavir chống lại 5 chủng HIV-1 khác nhau trong phòng thí nghiệm nằm trong khoảng 10-27 nM (0,006- 0,017 mcg/ml, 1 mcg/ml= 1,6 microM) và trong khoảng từ 4 - 11 nM (0.003 - 0.007 mcg/ml) đối với một số chủng HIV-1 phân lập được trên lâm sàng (n = 6). Khi có 50% huyết thanh người, nồng độ trung bình của lopinavir chống lại 5 chủng trong phòng thí nghiệm từ 65-289 nM (0,04-0,18 mcg/ml), yêu hơn 7 đến 11 lần. Những nghiên cứu về hoạt tính khi kết hợp thuốc kháng virus với lopinavir trên in vitro cho thấy tác dụng đổi vận với nelfinavir, tác dụng đồng vận với amprenavir, atazanavir, indinavir, saquinavir va tipranavir. Nồng độ có tác dụng (EC50) trung bình của lopinavir chống lại 3 chủng, HIV-2 khác nhau, từ 12-180 nM (0.008-113 µg/ml).
+ Kháng thuốc
Các chúng HIV-1 phân lập giảm nhạy với lopinavir đã được chọn lọc trên in vitro. Sự có mặt của ritonavir dường như không ảnh hưởng đến sự chọn lọc các virus kháng lopinavir in vitro.
Sự chọn lọc kháng với Kaletra ở những bệnh nhân chưa từng dùng thuốc kháng retrovirus chưa được biết rõ. Trong một nghiên cứu pha III trên 653 bệnh nhân chưa dùng thuốc kháng retrovirus (Nghiên cứu 863), các chủng virus huyết tương phân lập được từ mỗi bệnh nhân điều trị có HIV huyết tương > 400 bản sao/ml ở tuần 24, 32, 40 và/hoặc 48 được phân tích. Trong số 37 bệnh nhân điều trị
Bằng Kaletra được đánh giá. không quan sát thấy bằng chứng kháng Kaletra về cả kiểu gen và kiểu hình (0%). Bằng chứng về kháng kiểu gen với nelfinavir, được xác định bởi sự hiện diện các đột biến D30N và/hoặc L90M trong protease HIV, quan sát được ở 25/76 bệnh nhân (33%). Sự chọn lọc kháng Kaletra ở bệnh nhi chưa từng dùng thuốc kháng retrovirus (Nghiên cứu 940) phù hợp với kết quả quan sát được ở bệnh nhân người lớn (Nghiên cứu 863).
Kháng thuốc với Kaletra đã được thấy xuất hiện ở bệnh nhân được điều trị bằng các thuốc ức chế protease khác trước khi điều trị bằng Kaletra. Trong các nghiên cứu pha II trên 227 bệnh nhân chưa điều trị kháng virus hay đã dùng các thuốc ức chế protease, các chủng phân lập từ 4/23 bệnh nhân có lượng RNA virus có thể đo được (> 400 bản sao/ml) sau khi điều trị bằng Kaletra trong 12 -100 tuần cho thấy giảm đáng kể độ nhạy với lopinavir khi so với các chủng virus tương ứng phân lập trước điều trị. Ba trong số những bệnh nhân này đã từng nhận đơn trị liệu thuốc ức chế protease (nelfmavir, indinavir, hay saquinavir) và một bệnh nhân nhận đa trị liệu các thuốc ức chế protease (indinavir, saquinavir va ritonavir). Cả 4 bệnh nhân này ít nhất có 4 đột biến liên quan đến kháng thuốc với các ức chế protease ngay trước khi điều trị bằng Kaletra. Sau khi virus hồi phục, các chủng phân lập từ tất cả những bệnh nhân này đều có thêm các đột biến, một số có lien quan đến kháng với thuốc ức chế protease. Tuy nhiên, tại thời điểm này, chưa đủ dữ liệu để xác định là các kiểu đột biến trong các mẫu phân lập từ bệnh nhân điều trị bằng Kaletra có liên quan đến lopinavir hay không. Việc đánh giá các kiểu đột biến này còn đang được nghiên cứu.
+ Kháng chéo
Nghiên cứu tiền lâm sàng.
Có nhiều mức độ kháng chéo khác nhau quan sát được giữa các thuốc ức chế protease. Rất ít thông tin thích hợp về kháng chéo của virus làm giảm nhạy cảm với lopinavir trong khi điều trị bằng Kaletra.
Hoạt tính in vitro của lopinavir đối với các chủng phân lập trên lâm sàng từ những bệnh nhân đã từng điều trị bằng một thuốc ức chế protease được xác định. Các chủng phân lập cho thấy giảm nhạy > 4 lần với nelfinavir (n=13) và saquinavir (n=4), giảm nhạy < 4 lần với lopinavir. Các chủng phân lập giảm nhạy > 4 lần với indinavir (n=16) và ritonavir (n=3) cho thấy giảm nhạy trung bình tương ứng 5,7 lần và 8.3 lần với lopinavir. Các chủng phân lập từ bệnh nhân trước đây đã được điều trị bằng hai hay nhiều hơn các thuốc ức chế protease cho thấy giảm nhạy với lopinavir nhiều hơn như mô tả ở dưới đây.
Các nghiên cứu lâm sàng: Hoạt tính kháng virus của Kaletra ở bệnh nhân đã dùng thuốc ức chế protease
Sự tương quan về lâm sàng với giảm nhạy lopinavir trong nuôi cấy tế bào đã được kiềm tra bằng cách đánh giá đáp ứng virus học với Kaletra trên bệnh nhân đã từng được điều trị ARV trước đó, với xét nghiệm kiểu gen ban đầu ở 3 nghiên cứu và xét nghiệm kiểu hình ban dầu ở 1 nghiên cứu.
Đáp ứng virus học với Kaletra cho thấy bị ảnh hưởng bởi sự hiện diện của ≥ 3 thành phần acid amin sau đây trong men protease ngay trước khi điều trị: LI0F/1/R/V, K20M/N/R, L241, L33F, M361, 147V, G48V, I54L/T/V, V82A/C/F/S/T và 184V. Bảng 7 cho thấy đáp ứng virus học sau 48 tuần (RNA HIV <400 bản sao/ml) theo số lượng các đột biến kháng với thuốc ức chế protease nêu trên tại thời điểm trước khi điều trị trong các Nghiên cứu 888. Nghiên cứu 765 và Nghiên cứu 957 (xem bên dưới). Không dùng phác đồ Kaletral lần/ngày cho bệnh nhân có ≥ 3 thành phần trên.
Bảng 10. Đáp ứng virus học (RNA HIV < 400 bản sao/ml) ở tuần thứ 48 dựa vào độ nhạy với Kaletra trước khi điều trị và số đột biến trên protease liên quan với việc giảm đáp ứng với Kaletra1
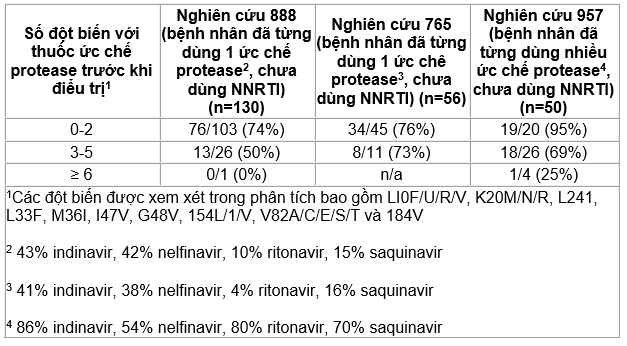
Đáp ứng virus học với Kaletra đối với kiểu hình nhạy với lopinavir ban đầu đã được kiểm tra trong nghiên cứu 957. Trong nghiên cứu này, 56 bệnh nhân chưa từng điều trị bằng NNRTI có RNA HIV > 1000 bản sao/ml mặc dù trước đó có điều trị với ít nhất 2 chất ức chế protease trong số các thuốc nelfinavir, indinavir, saquinavir va ritonavir, ngẫu nhiên nhận 1 trong 2 liều Kaletra phối hợp với efavirenz và các thuốc ức chế men sao chép ngược Nucleosid. Trị số EC50 của lopinavir với 56 chủng virus phân lập ban đầu thay đổi ở trong khoảng từ 0.5 lần đến 96 lần cao hơn so với EC50 của chủng HIV hoang dã. 55% (31/56) chủng virus phân lập ban đầu giảm nhạy với lopinavir > 4 lần. 31 mẫu phân lập này có độ nhạy với lopinavir giảm trung bình 18 lần. Bảng 8 cho thấy đáp ứng với điều trị bằng độ nhạy ban đầu với lopinavir.
Bảng 11: Đáp ứng virus học HIV-1 RNA dựa vào độ nhạy' với lopinavir ở tuần 48

DỮ LIỆU VỀ TÍNH AN TOÀN TIỀN LÂM SÀNG
+ Độc tính cấp, bán cấp và mạn tính
Những nghiên cứu về độc tính với liều nhắc lại trên động vật gặm nhấm và chó đã xác định những cơ quan đích chính là gan, thận, tuyến giáp, lách và hồng cầu. Những thay đổi ở gan cho thấy sự sưng phồng tế bào với thoái hóa ở phần trung tâm. Trong khi phơi nhiễm gây ra những thay đổi này tương đương với phơi nhiễm trên lâm sàng ở người, nhưng liều cho động vật là gấp trên 6 lần liều khuyến cáo dùng trên lâm sàng. Sự thoái hóa nhẹ ống thận đã được thấy ở chuột nhắt phơi nhiễm với ít nhất 2 lần so với liều khuyến cáo ở người; thận không bị ảnh hưởng ở chuột cống và chó. Thyroxin trong huyết thanh giảm dẫn đến tăng giải phóng TSH gây nên phì đại tế bào nang tuyến giáp của chuột cống. Những thay đổi này có thể phục hồi được khi ngừng thuốc nhưng không thấy ở chuột nhắt và chó. Hồng cầu không đều và hồng cầu biến dạng âm tính với thử nghiệm Coombs được thấy ở chuột cống, nhưng không thấy ở chuột nhắt hay chó. Phì đại lách cùng với chứng mô bào huyết được thấy ở chuột cống nhưng không thấy ở các loài khác.Cholesterol huyết thanh tăng ở những động vật gặm nhấm nhưng không tăng ở chó, trong khi đó triglycerid chỉ tăng ở chuột nhắt.
+ Tính sinh ung thư và sinh đột biến
Các nghiên cứu tính sinh ung thư về lâu dài của lopinavir/ritonavir ở chuột nhắt cho thấy thuốc gây kích ứng quá trình phân chia tế bào, nhưng không gây độc cho hệ gen ở các khối u gan, thường được xem ít có nguy cơ ở người. Các nghiên cứu sinh ung thư ở chuột cống cho thấy thuốc không gây ung thư. Lopinavir không gây đột biến hay làm gây gen trong các thử nghiệm in vitro bao gồm kỹ thuật Ames gây đột biển đảo nghịch ở vi khuẩn, thử nghiệm u bạch huyết ở chuột nhắt, thử nghiệm biến dị nhiễm sắc thể ở tế bào lympho người. Lopinavir/ritonavir không gây đột biến hay làm gay gen trên in vivo bằng kỹ thuật vi nhân ở chuột nhắt.
BẢO QUẢN
Bảo quản dung dịch Kaletra dạng uống ở nhiệt độ 36-46°F (2-8°C) cho đến khi dùng. Tránh để gần nơi có nhiệt độ cao. Đối với bệnh nhân, bảo quản lạnh dung dịch uống Kaletra để giữ cho thuốc ổn định cho đến hạn sử dụng in trên nhãn. Nếu bảo quản ở nhiệt độ phòng không quá 77°F (25°C) cần dùng thuốc trong vòng 2 tháng.
DẠNG ĐÓNG GÓI
Dung dịch uống Kaletra là chất lỏng có màu vàng nhạt đến màu vàng cam, đóng lọ nhiều liều có màu hổ phách chai 160 ml. Mỗi 5 ml dung dịch chứa 400 mg lopinavir/100 mg ritonavir. Mỗi chai kèm theo một cốc nhỏ chia liều (80mg lopinavir/20 mg ritonavir/ml).
Nhà sản xuất: Abbott Laboratories, Abbott Park, IL 60064, U.S.A.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









