️ Cường giáp thứ phát do u tuyến yên
- U tuyến yên tiết TSH là một bệnh lý hiếm gặp, được định nghĩa là một adenoma các tế bào sản xuất TSH của tuyến yên. Đặc trưng của bệnh bao gồm sự tăng nồng độ các hormone tuyến giáp (fT4, fT3) đi kèm với nồng độ TSH không bị ức chế tương xứng (bình thường hoặc tăng). Bệnh nhân thường xuất hiện với bệnh cảnh nhiễm độc giáp nhẹ, trung bình kèm các triệu chứng ở thị giác và thần kinh do khối u chèn ép.
- Chẩn đoán xác định bệnh cần kết hợp các xét nghiệm hormone giáp (fT3, fT4), TSH, các nghiệm pháp động (như nghiệm pháp kích thích bằng TRH, nghiệm pháp ức chế bằng T3) và hình ảnh học tuyến yên.
- Phẫu thuật lấy u qua xoang bướm là chọn lựa ưu tiên và thường đem lại hiệu quả khỏi bệnh cao, hiếm khi tái phát. Trong trường hợp chẩn đoán nhầm thành cường giáp nguyên phát tại tuyến giáp không đáp ứng với điều trị nội khoa, việc cắt bỏ tuyến giáp có thể làm cho khối u tuyến yên phát triển lớn hơn.
Lịch sử: Năm 1960, Jailer và Holub lần đầu tiên mô tả khả năng tăng tiết TSH quá mức của tuyến yên dẫn đến các triệu chứng nhiễm độc giáp với tên gọi Hội chứng tăng tiết TSH không thích hợp (2). Sau đó 10 năm, Hamilton mới chính thức báo cáo trên tạp chí NEJM về trường hợp bệnh nhân nam, 50 tuổi, ghi nhận khối adenoma lành tính ở tuyến yên tăng sản xuất TSH. Bệnh nhân đạt bình giáp sau phẫu thuật cắt u qua mổ mở sọ và xạ trị ngoài (3). Do nhiều hạn chế về xét nghiệm và hình ảnh học tại thời điểm đó nên phải đến năm 2013, Hiệp hội tuyến giáp châu Âu lần đầu tiên đưa ra phác đồ hướng dẫn chẩn đoán và điều trị U tuyến yên tiết TSH (4).
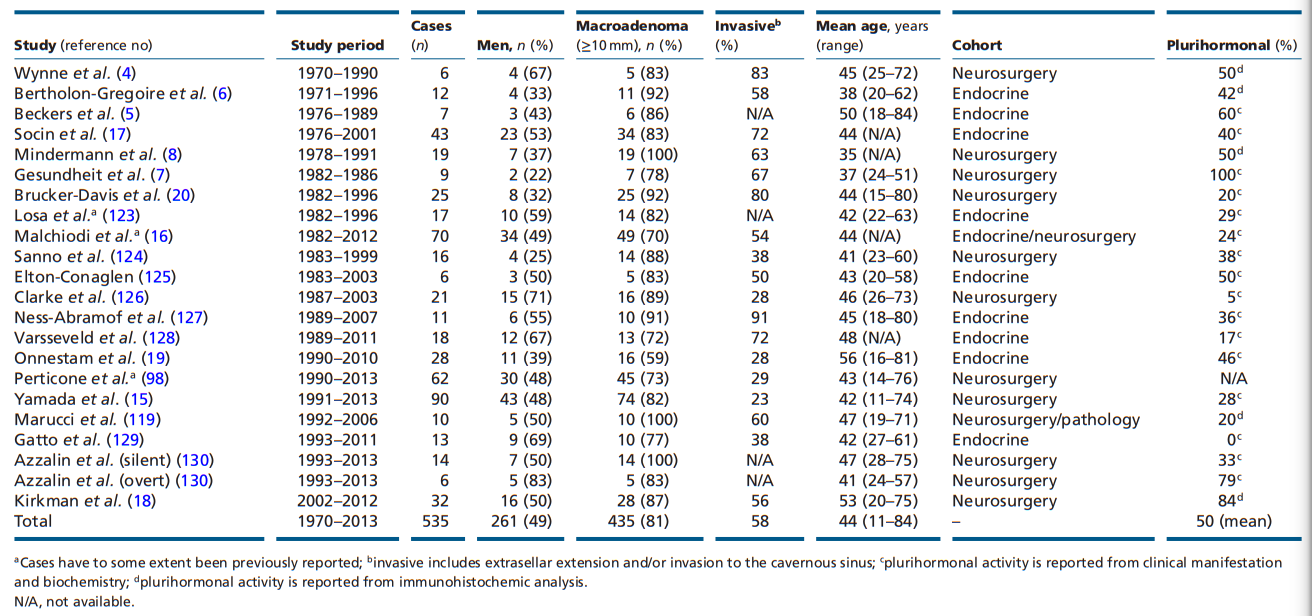
Dịch tễ học: Từ năm 1970 đến 2013 ghi nhận có 535 ca u tuyến yên tiết TSH. Trong đó, tỉ lệ phát hiện ở nam:nữ gần tương đương nhau với tuổi chẩn đoán dao động từ 11 đến 84 tuổi. Trên 80% bệnh nhân có kích thước u trên 1cm (macroadenoma) và 58% bệnh nhân có u xâm lấn tại thời điểm phát hiện (Bảng 1).
Mô bệnh học
Tế bào tiết TSH chỉ chiếm 5% số tế bào tiết ở tuyến yên, điều này cũng lý giải phần nào tần suất khá hiếm của bệnh lý này. Trong số các khối u tiết TSH được ghi nhận, trên 70% là tiết đơn độc TSH, còn lại là đồng tiết với ít nhất một loại hormone khác của tuyến yên trước bao gồm GH, Prolactin, LH/FSH. Hiếm trường hợp ghi nhận đồng tiết với ACTH (Bảng 2). Các tế bào u thường có dạng đa giác nhân lớn, kỵ màu, lan tỏa. U thường xơ chắc, có khi có vôi hóa trong u. Mô học đa dạng tùy vào mức độ biệt hóa của u. Để phân biệt lành tính hay ác tính chỉ có thể dựa vào di căn, gần như không có đặc điểm tế bào học nào đặc hiệu. Tuy nhiên, điều đáng mừng là rất hiếm khả năng ademoma lành tính chuyển dạng sang carcinoma. Nguyên nhân và cơ chế phân tử dẫn đến hình thành khối u tiết TSH vẫn chưa rõ
Chẩn đoán
Xét nghiệm fT3, fT4 tăng kết hợp với nồng độ TSH không bị ức chế gợi ý một tình trạng tăng tiết TSH không thích hợp. Xét nghiệm này nên được lặp lại ít nhất vài lần bằng nhiều phương pháp định lượng khác nhau, cũng như cần loại trừ các nguyên nhân gây nhiễu khác như thuốc, estrogen, thai kỳ. Bệnh lý tự miễn tại tuyến giáp cũng cần được loại trừ bằng xét nghiệm các kháng thể kháng tuyến giáp như Anti-TPO, TRAb. Để hướng đến chẩn đoán nguyên nhân từ tuyến yên, chức năng tuyến yên trước cũng cần được đánh giá gồm Cortisol 8g sáng, LH, FSH, estrogen, testosterone, Prolactin, IGF-1. Đồng thời, chụp cộng hưởng từ tuyến yên giúp chẩn đoán xác định có u hay không và vị trí u. Tuy nhiên, trong trường hợp không xác định được u tuyến yên, chẩn đoán phân biệt cần được chú ý là hội chứng đề kháng hormone giáp ở ngoại biên. Trong trường hợp này, cần làm thêm các nghiệm pháp động như nghiệm pháp ức chế bằng T3, nghiệm pháp kích thích bằng TRH, đo tỉ số αGSU/TSH, đo hoạt động của TSH tại mô ngoại biên (SHBG, ICTP) và điều trị thử với Somatosatin analogs. Trong một số trường hợp phức tạp hơn, phân tích gen để phát hiện các đột biến trên các trình tự mã hóa cho gen TRα và TRβ có giá trị gợi ý chẩn đoán hội chứng đề kháng hormone giáp ở ngoại biên. (1, 6, 7)
Điều trị và theo dõi: Phương pháp điều trị bao gồm phẫu thuật và điều trị nội khoa.
- Phẫu thuật là lựa chọn hàng đầu cho các bệnh nhân u tuyến yên tiết TSH. Đa số bệnh nhân có microadenoma sẽ loại bỏ được u hoàn toàn bằng phẫu thuật lấy u qua xoang bướm hoặc dưới trán. Tuy nhiên, trên 40% bệnh nhân có macroadenoma sẽ vẫn còn nguy cơ sót mô u, nguyên nhân chính là do mô xơ cứng và tình trạng xâm lấn vào các vùng lận cận. Phương pháp xạ tuyến yên hoặc xạ phẫu bằng gamma knife không đem lại hiệu quả cao. Trước phẫu thuật, bệnh nhân cần được điều trị nội khoa để đưa hormone giáp về gần bình thường bằng thuốc kháng giáp (nhóm methimazole hoặc propylthiouracil), somatostatin analogs (ngoài tác dụng bình giáp còn giúp giảm bớt kích thước u trong vòng 6-12 tháng trước phẫu thuật) và propranolol (40-160mg/ngày). Các thuốc này nên được ngưng 10 ngày trước phẫu thuật để đánh giá đáp ứng sau mổ. Theo dõi biến chứng sau phẫu thuật bao gồm chảy máu, rỉ dịch não tủy, đái tháo nhạt và suy yên (khoảng 50% bệnh nhân sau phẫu thuật có thiếu hụt các hormone khác của tuyến yên).
- Điều trị nội khoa: Do các tế bào u tiết TSH biểu hiện thụ thể của somatostatin nên điều trị bằng các somatostatin analogs tác dụng kéo dài (octreotide LAR ® or lanreotide SR ® or lanreotide Autogel ®) cho thấy hiệu quả trong việc giảm nồng độ TSH. Hiệu quả có thể đạt được trong khoảng 10 ngày đến 20 tháng sau điều trị. 90% bệnh nhân sau điều trị đạt được bình giáp và 30% bướu giáp giảm kích thước. Kích thước khối u nhỏ lại ghi nhận ở 40% bệnh nhân được điều trị với somatostatin analogs với 70% số bệnh nhân này cải thiện được thị trường. Tác dụng phụ thường gặp của somatostatin analogs bao gồm buồn nôn, đầy bụng, tiêu chảy, rối loạn tiêu hóa, rối loạn dung nạp glucose và sỏi mật. Ngoài somatostatin analogs, đồng vận thụ thể dopamine típ 2 (bromocriptine hay cabergoline) cũng có thể cân nhắc điều trị kết hợp ở các bệnh nhân có đồng tiết prolactin hoặc ở bệnh nhân phẫu thuật thất bại, không thể phẫu thuật và không thể điều trị được với somatostatin analogs.
Theo dõi
Tiêu chuẩn khỏi bệnh bao gồm nồng độ TSH 7 ngày sau phẫu thuật giảm thấp đến ngưỡng không phát hiện được trước và sau khi ức chế bằng T3, không đáp ứng với kích thích bằng TRH. Theo dõi TSH, fT4 mỗi 4-6 tháng/năm đầu, sau đó mỗi năm. MRI tuyến yên mỗi 2-3 năm. Tiên lượng tái phát thấp, nếu có thường xảy ra sau 1 năm.
TLTK
- Tjornstrand A, Nystrom HF. DIAGNOSIS OF ENDOCRINE DISEASE: Diagnostic approach to TSH-producing pituitary adenoma. European journal of endocrinology. 2017;177(4):R183-R97.
- Jailer JW, Holub DA. Remission of Graves’ disease following radiotherapy of a pituitary neoplasm. The American Journal of Medicine. 1960;28(3):497-500.
- Hamilton CR, Adams LC, Maloof F. Hyperthyroidism Due to Thyrotropin-Producing Pituitary Chromophobe Adenoma. New England Journal of Medicine. 1970;283(20):1077-80.
- Beck-Peccoz P, Lania A, Beckers A, Chatterjee K, Wemeau JL. 2013 European thyroid association guidelines for the diagnosis and treatment of thyrotropin-secreting pituitary tumors. European thyroid journal. 2013;2(2):76-82.
- Beck-Peccoz P, Persani L, Lania A. Thyrotropin-Secreting Pituitary Adenomas. In: Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dhatariya K, et al., editors. Endotext. South Dartmouth (MA): MDText.com, Inc.
- Amlashi FG, Tritos NA. Thyrotropin-secreting pituitary adenomas: epidemiology, diagnosis, and management. Endocrine. 2016;52(3):427-40.
- Beck-Peccoz P, Persani L, Mannavola D, Campi I. Pituitary tumours: TSH-secreting adenomas. Best practice & research Clinical endocrinology & metabolism. 2009;23(5):597-606.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









