Mối quan hệ giữa rung nhĩ và suy tim
Rung nhĩ và suy tim: hai bệnh lý có mối quan hệ gần
Rung nhĩ và suy tim là hai bệnh lý tim mạch phổ biến trên toàn cầu. Hơn ½ bệnh nhân rung nhĩ có tình trạng suy tim suy giảm chức năng tâm thu thất trái. Ngược lại, gần ½ bệnh nhân suy giảm chức năng tâm thu thất trái bị rung nhĩ1 – 3. Nếu mắc một trong hai bệnh lý này, bệnh nhân hoàn toàn có thể mắc bệnh lý còn lại, và đồng thời giảm tiên lượng bệnh. Tuy nhiên, cho đến nay một vấn đề vẫn chưa được làm rõ là suy giảm chức năng tâm thu thất trái xảy ra trước rung nhĩ hay ngược lại? Mối quan hệ nhân quả giữa rung nhĩ và suy giảm chức năng tâm thu thất trái vẫn còn là một vấn đề chưa được sáng tỏ, hệt như câu hỏi “quả trứng có trước hay con gà có trước?” (hình 1)3.
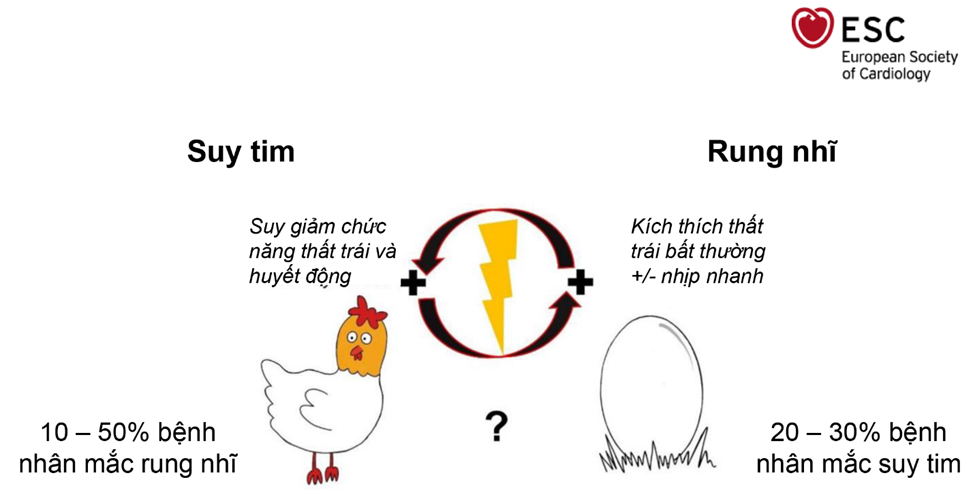
Bằng chứng lâm sàng hiện có cho rằng rung nhĩ có thể gây ra suy giảm chức năng tâm thu thất trái và những bệnh lý cũng như tử vong liên quan đến suy tim. Thử nghiệm CASTLE – AF đã chứng tỏ triệt đối rung nhĩ bằng catheter có thể cải thiện nguy cơ tử vong, nhập viện vì suy tim và suy giảm chức năng tâm thu thất trái ở bệnh nhân suy tim với phân suất tống máu giảm và rung nhĩ4. Tuy nhiên, cần phải lưu ý rằng, ngoài rung nhĩ thì những bệnh nhân trong thử nghiệm cũng mắc kèm các bệnh lý khác có thể gây ra tình trạng suy giảm chức năng tâm thu thất trái. Thử nghiệm CAMERA – MRI tiến hành trên bệnh nhân rung nhĩ và mắc bệnh cơ tim vô căn (với phân suất tống máu thất trái ≤ 45%), trong đó những nguyên nhân xác định khác gây suy giảm chức năng tâm thu thất trái như bệnh động mạch vành đã được loại trừ5. Trong thử nghiệm này, kiểm soát nhịp bằng triệt đốt rung nhĩ bằng catheter cải thiện chức năng thất trái so với những bệnh pháp kiểm soát nhịp bằng thuốc. Tuy nhiên, các nghiên cứu khác trước đây về các liệu pháp kiểm soát nhịp ở bệnh phân suy giảm chức năng tâm thu thất trái lại cho ra kết quả trái ngược, nghĩa là kiểm soát nhịp bằng thuốc mang lại nhiều lợi ích hơn bằng biện pháp triệt đốt bằng catheter6.
Mặc dù rung nhĩ có thể gây ra suy tim, tuy nhiên suy tim cũng có thể dẫn đến rung nhĩ, bằng chứng là một bộ phận lớn bệnh nhân suy tim mắc kèm rung nhĩ theo thời gian. Cơ chế có thể là do tăng áp lực tâm nhĩ trái, dẫn đến giãn rộng liên tục tâm nhĩ cũng như tái cấu trúc bất lợi trên cơ tim và điện tim. Ở bệnh nhân chỉ mắc rung nhĩ, bệnh lý cơ tim cũng có thể cảm ứng rung nhĩ [7]. Do vậy, xác định và phân loại bệnh nhân rung nhĩ và suy tim và vấn đề quan trọng hàng đầu để đưa ra chiến lược kiểm soát cá nhân hóa phù hợp.
Cơ chế đề nghị
Những bằng chứng khoa học về rung nhĩ đa số tập trung vào tâm nhĩ, những ảnh hưởng sinh bệnh học của rung nhĩ đối với thất trái thì vẫn chưa được làm rõ. Cơ tim ở tâm thất trái của bệnh nhân rung nhĩ cho thấy không có sự tái cấu trúc cơ tim liên quan đến xơ hóa tâm thất trái. Tuy nhiên, các tế bào cơ tim ở tâm thất của bệnh nhân rung nhĩ được đặc trưng bởi tình trạng giảm biên độ Ca2+ tâm thu thoáng qua, yếu tố này quyết định rất nhiều khả năng co bóp của tâm thu. Ngoài ra, mô phỏng in vitro cũng cho thấy rung nhĩ với tần suất bình thường cũng làm giảm Ca2+ tâm thu ở tế bào cơ tim thất trái của người. Như vậy có thể thấy rằng tái cấu trúc bất lợi trên tâm thất do rung nhĩ đã được mô phỏng bằng những cách tiếp cận khác nhau, từ thử nghiệm lâm sàng cho tới mô phỏng trên tế bào in vitro. Hình 2 mô tả cơ chế tác động của rung nhĩ đến thất trái.
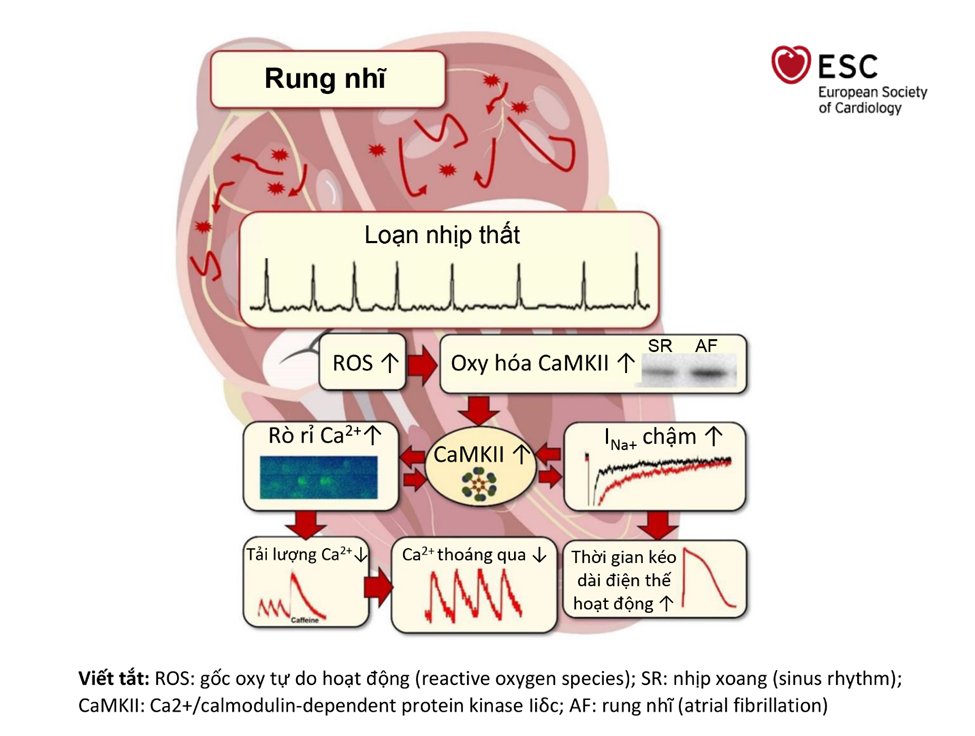
Các thử nghiệm khác cho thấy việc tăng rò rỉ Ca2+ trong lưới cơ tương của tâm trương trong tế bào cơ tim induced pluripotent stem cell cardiomyocytes (iPSC) có thể dẫn đến việc giảm tải lượng Ca2+ trong lưới cơ tương sau khi mô phỏng rung nhĩ. Liên quan đến tình trạng rối loạn cân bằng nộ môi Ca2+, nồng độ Na2+ trong dịch tế bào tăng, có thể do tăng dòng Na+ chậm, cuối cùng làm kéo dài điện thế hoạt động thất sau rung nhĩ.
Các thử nghiệm khác cũng cho thấy nồng độ các gốc oxy tự do hoạt động tăng lên ở tế bào cơ tim thất trái ở bệnh nhân rung nhĩ, dẫn đến tăng oxy hóa Ca2+/calmodulin-dependent protein kinase IIδc (CaMKII). Tình trạng này là nguyên nhân chủ chốt gây ra tình trạng tái cấu trúc kém đáp ứng ở các bệnh nhân mắc bệnh tim mạch. Khi hoạt động oxy hóa của CaMKII tăng lên, hậu quả là sự gia tăng phosphyl hóa của thụ thể ryanodine ở tâm thất của bênh nhân rung nhĩ. Hiện tượng này làm tăng khả năng rò rỉ của các kênh, giải thích cho kết quả Ca2+ tâm trương bị rò rỉ trong tâm thất của bệnh nhân rung nhĩ. Thuốc ức chế CaMKII hoặc thuốc loại bỏ các gốc oxy hóa có thể cải thiện tình trạng trong thử nghiệm mô phỏng rung nhĩ là bằng chứng cho sự hợp lý của cơ chế đề xuất3.
Kết luận
Như vậy, qua những bằng chứng hiện có, có thể thấy rằng rung nhĩ gây ra một số tác động bất lợi trên tâm thất. Cơ chế của những tác động bất lợi này bước đầu đã được phác thảo qua các thử nghiệm lâm sàng và thử nghiệm in vitro mô phỏng rung nhĩ trên tế bào. Tuy nhiên, để có thể làm sáng tỏ cơ chế của mối liên hệ này, cụ thể là những tác hại trên tâm thất gây ra do rung nhĩ, thì các nghiên cứu khác về cơ chế bao gồm sự biến đổi chuyển hóa, điều hóa kênh ion, ức chế viêm và ức chế oxy hóa là cần thiết.
Tài liệu tham khảo
- Santhanakrishnan R, Wang N, Larson MG, Magnani JW, McManus DD, Lubitz SA, et al. Atrial fibrillation begets heart failure and vice versa: temporal associations and differences in preserved versus reduced ejection fraction. Circulation 2016;133:484–492.
- Sossalla S, Vollmann D. Arrhythmia-induced cardiomyopathy. Dtsch Arztebl Int 2018;115:335–341.
- Steffen Pabel, Samuel Sossalla, Atrial fibrillation and heart failure: novel insights into the chicken and egg dilemma, European Heart Journal, 2022; ehac257, https://doi.org/10.1093/eurheartj/ehac257
- Marrouche NF, Brachmann J, Andresen D, Siebels J, Boersma L, Jordaens L, et al. Catheter ablation for atrial fibrillation with heart failure. N Engl J Med 2018;378:417–427.
- Prabhu S, Taylor AJ, Costello BT, Kaye DM, McLellan AJA, Voskoboinik A, et al. Catheter ablation versus medical rate control in atrial fibrillation and systolic dysfunction: the CAMERA-MRI study. J Am Coll Cardiol 2017;70:1949–1961.
- Chen S, Purerfellner H, Meyer C, Acou WJ, Schratter A, Ling Z, et al. Rhythm control for patients with atrial fibrillation complicated with heart failure in the contemporary era of catheter ablation: a stratified pooled analysis of randomized data. Eur Heart J 2020;41:2863–2873.
- Wijesurendra RS, Liu A, Eichhorn C, Ariga R, Levelt E, Clarke WT, et al. Lone atrial fibrillation is associated with impaired left ventricular energetics that persists despite successful catheter ablation. Circulation 2016;134:1068–1081.






