Cơ chế bệnh học của hen phế quản
1. Tóm tắt
Hen phế quản là một bệnh đa kiểu hình, thường được đặc trưng bởi tình trạng viêm mạn tính đường dẫn khí. Viêm mạn tính đường dẫn khí gây tăng đáp ứng của đường dẫn khí với các kích thích trực tiếp hoặc gián tiếp, từ đó gây ra triệu chứng hen. Sinh bệnh học của hen tương đối phức tạp. Bất thường sinh lý chính trong hen là những đợt tắc nghẽn đường dẫn khí được đặc trưng bởi giới hạn luồng khí thở ra.
Tổn thương mô bệnh học nổi bật của hen là tình trạng viêm mạn tính đường dẫn khí, thỉnh thoảng đi kèm với tình trạng tái cấu trúc đường dẫn khí. Những biến đổi về sinh lý và mô bệnh học trong hen là do các tế bào viêm, tế bào cấu trúc đường dẫn khí và nhiều hóa chất trung gian tương tác với nhay gây ra. Hiểu được cơ chế và hậu quả của quá trình viêm đường dẫn khí trong hen sẽ giúp bác sĩ tiếp cận bệnh nhân hen phù hợp hơn.
Nguyên nhân gây ra bệnh hen vẫn chưa được xác định, nhưng bệnh hen có thể là kết quả của sự phối hợp nhiều yếu tố nguy cơ, gồm yếu tố bản thân và yếu tố môi trường. 10 Hen là một bệnh đa kiểu hình, thường được đặc trưng bởi tình trạng viêm mạn tính đường dẫn khí. Viêm mạn tính đường dẫn khí gây ra tình trạng tăng đáp ứng của đường dẫn khí với các kích thích trực tiếp hoặc gián tiếp, từ đó gây ra triệu chứng hen. Những tình trạng này thường tồn tại dai dẳng, thậm chí khi bệnh nhân không có triệu chứng hoặc chức năng hô hấp bình thường, nhưng có thể trở thành bình thường khi được điều trị hợp lý. 11 Những biến đổi sinh bệnh học đặc trưng trong hen là do các tế bào viêm và nhiều hóa chất trung gian gây ra.
2. Biến đổi mô bệnh học của đường dẫn khí trong hen
Đặc điểm mô bệnh học của hen giống hệt nhau ở các kiểu hình hen khác nhau: hen dị ứng (ngoại sinh), hen không dị ứng (nội sinh), hen nghề nghiệp, hen do aspirin và hen ở trẻ em. 10 Những biến đổi mô bệnh học này thấy ở toàn bộ đường dẫn khí, nhưng không thấy ở nhu mô phổi; đặc biệt bệnh nhân hen nặng hơn thì có tình trạng viêm ở các phế quản nhỏ hơn.
Những biến đổi cấu trúc của phế quản (hay được mô tả là tái cấu trúc phế quản) trong hen bao gồm: tăng sản tế bào đài, xơ hóa và dầy màng nền do lắng đọng collagen ở lớp dưới niêm, phì đại và tăng sản cơ trơn phế quản, tăng sản mạch máu và phì đại tuyến nhầy ở lớp dưới niêm (Hình 1)
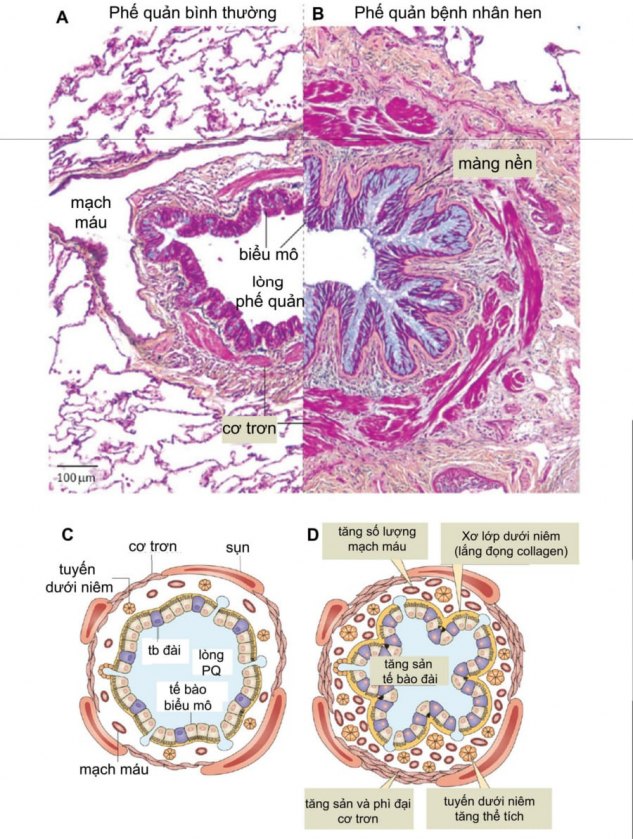
Cấu trúc phế quản kích thước trung bình ở người bình thường (Hình A; giản đồ sơ lược được thể hiện trong Hình C) và người bị hen (Hình B; giản đồ sơ lược được thể hiện trong Hình D). Có hiện tượng tái cấu trúc phế quản trong hen: tăng sản tế bào đài, xơ hóa và dầy lớp màng nền, tăng sản mạch máu, phì đại tuyến dưới niêm, và tăng thể tích cơ trơn. (Nguồn: Fahy JV. Type 2 inflammation in asthma–present in most, absent in many. Nat Rev Immunol 2015;15:57-65)
Dưới kính hiển vi, phế quản của bệnh nhân hen bị hẹp lại, sung huyết và phù nề. Niêm mạc phế quản bị bạch cầu ái toan đã hoạt hóa và các tế bào lympho T xâm nhập. Các dưỡng bào trong niêm mạc cũng bị hoạt hóa. Do lớp tế bào biểu mô thường bở và dễ bị bong tróc nên sẽ làm tăng số lượng tế bào biểu mô trong lòng phế quản. Sung huyết là do có hiện tượng dãn mạch và tăng sinh mạch máu ở lớp dưới niêm. Thành của phế quản dầy lên và bị phù nề, đặc biệt trong trường hợp hen ác tính. Một biểu hiện khác thường gặp trong hen ác tính là tình trạng bít tắc lòng phế quản do sự hiện diện của nút nhầy. Nút nhầy gồm glycoprotein do tế bào đài tiết ra và protein huyết tương do hiện tượng thoát mạch. 3
3. Viêm đường dẫn khí trong hen
Ở bệnh nhân hen, có tình trạng viêm niêm mạc từ khí quản đến tiểu phế quản tận, nhưng chủ yếu là ở các phế quản (đường dẫn khí có sụn); tuy nhiên, cách các tế bào viêm tương tác với nhau và làm sao tình trạng viêm gây ra triệu chứng hen vẫn chưa được rõ (Hình 2). 3 Mức độ viêm đường dẫn khí tương quan kém với độ nặng của bệnh và tình trạng viêm này thậm chí hiện diện ở bệnh nhân bị dị ứng nhưng không có triệu chứng hen. Tình trạng viêm này thường giảm với điều trị bằng corticoid dạng hít (ICS). 3 Có bằng chứng rõ ràng rằng, tình trạng viêm trong hen liên quan đến tăng đáp ứng đường dẫn khí và rối loạn chức năng hô hấp từ đó gây ra tắc nghẽn đường dẫn khí không hằng định.
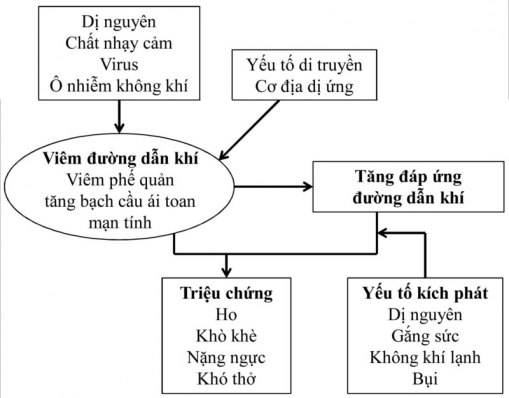
Hen là một bệnh mạn tính với tình trạng viêm tồn tại nhiều năm ở hầu hết bệnh nhân. 7 Cơ chế khiến tình trạng viêm tồn tại dai dẳng vẫn chưa rõ. Chồng lên tình trạng viêm mạn tính này là những đợt viêm cấp tính, tương ứng với những đợt kịch phát của hen. Kiểu viêm của hen mang tính chất của bệnh dị ứng, với các tế bào viêm tương tự như trong niêm mạc mũi ở bệnh nhân viêm mũi dị ứng. Mặc dù kiểu viêm thường gặp trong hen được đặc trưng bởi sự xâm nhập bạch cầu ái toan, vài bệnh nhân hen nặng có kiểu viêm tăng bạch cầu đa nhân trung tính. Kiểu viêm tăng bạch cầu đa nhân trung tính là kiểu viêm kém đáp ứng với corticoid. Nói chung, có nhiều loại tế bào viêm liên quan trong hen nhưng không có loại tế bào chính yếu nào là chiếm ưu thế (Hình 3).
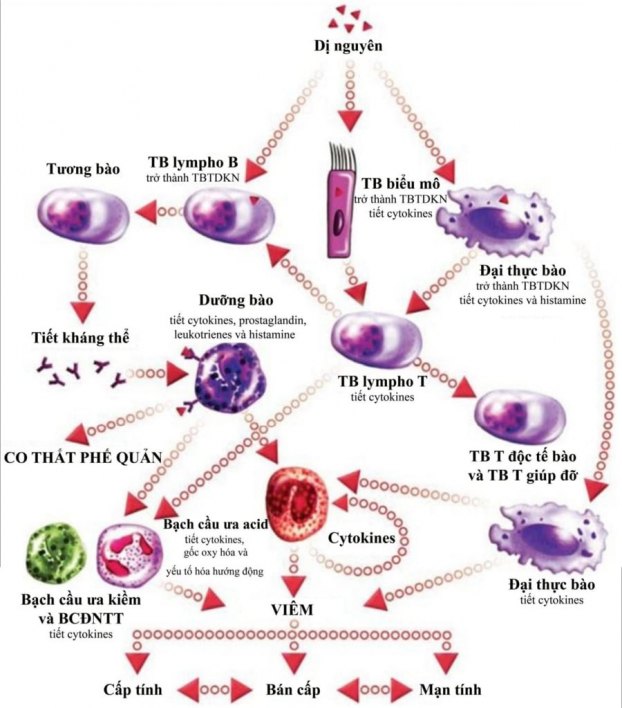
Khi các kháng nguyên hít vào bị bắt giữ bởi các tế bào trình diện kháng nguyên (TBTDKN) và được trình diện cho tế bào lympho T, giai đoạn viêm cấp tính xảy ra. Các tế bào lympho T giúp đỡ loại 2 (TH2) đã được hoạt hóa kích hoạt tế bào (TB) lympho B trở thành tương bào có khả năng sản xuất kháng thể. Tương bào tiết ra kháng thể IgE đặc hiệu kháng nguyên và các kháng thể này gắn vào thụ thể IgE trên dưỡng bào để hoạt hóa dưỡng bào. Dưỡng bào hoạt hóa tiết ra histamine và histamine lại gắn vào các thụ thể trên cơ trơn phế quản, từ đó gây co thắt và làm hẹp lòng phế quản. Những đợt viêm cấp tính như thế được lặp đi lặp lại nhiều lần gây ra viêm mạn tính ở đường dẫn khí với tình trạng tăng bạch cầu ái toan và/hoặc tăng bạch cầu đa nhân trung tính. (Nguồn: Wadsworth et al. Clinical update on the use of biomarkers of airway inflammation in the management of asthma. Journal of Asthma and Allergy 2011;4:77–86)
3.1 Các tế bào viêm
Dưỡng bào(mast cells): Dưỡng bào đóng vai trò quan trọng trong việc khởi phát cơn co thắt phế quản khi tiếp xúc dị nguyên và các yếu tố kích thích gián tiếp khác như gắng sức, tăng thông khí và sương mù. Dưỡng bào tiết ra các hóa chất trung gian gây co thắt phế quản như histamine, cysteinyl-leukotriene và prostaglandin D2 cũng như các cytokines, chemokines, yếu tố tăng trưởng và neurotrophins. 9 Ở người bị hen, dưỡng bào đã hoạt hóa hiện diện ở lớp niêm mạc và lớp cơ trơn phế quản; tăng số lượng dưỡng bào tại lớp cơ trơn có thể liên quan đến tình trạng tăng đáp ứng phế quản. 19Các dị nguyên hoạt hóa dưỡng bào qua cơ chế phụ thuộc kháng thể IgE. Kháng thể IgE đặc hiệu gắn kết vào dưỡng bào khiến dưỡng bào nhạy hơn với các yếu tố kích thích. Tầm quan trọng của IgE trong sinh bệnh học của hen được nhấn mạnh bởi các nghiên cứu cho thấy rằng kháng thể kháng IgE đã làm giảm triệu chứng hen và giảm số đợt kích phát. 3
Đại thực bào(macrophages): Đại thực bào bắt nguồn từ đơn bào máu, có thể di chuyển vào đường dẫn khí và bị dị nguyên hoạt hóa thông qua thụ thể IgE ái lực thấp (Fc ε RII). Đại thực bào có khả năng khởi phát kiểu đáp ứng viêm thông qua việc tiết một số cytokines. 18 Tuy nhiên, đại thực bào cũng tiết ra các hóa chất trung gian kháng viêm như interleukine-10 (IL-10) nên vai trò của chúng trong hen vẫn chưa rõ.
Tế bào đuôi gai (dendritic cells): Tế bào đuôi gai là những tế bào trình diện kháng nguyên chính, chúng giống đại thực bào chuyên biệt trong biểu mô đường dẫn khí. Tế bào đuôi gai bắt giữ dị nguyên trên bề mặt đường dẫn khí, biến chúng thành các peptides và di chuyển đến hạch lympho tại vùng. Tại đây, tế bào đuôi gai trình diện các peptides dị nguyên cho các tế bào lympho T nguyên thủy để lập chương trình sản xuất các tế bào lympho T đặc hiệu kháng nguyên. Các tế bào đuôi gai còn thúc đẩy việc biệt hóa tế bào lympho T non trở thành tế bào tế bào lympho T giúp đỡ loại 2 (TH2). 1 Ở bệnh nhân hen, cytokine TSLP (thymic stromal lymphopoietin) được tiết bởi tế bào biểu mô phế quản kích thích tế bào đuôi gai tiết chemokines để thu hút tế bào TH2 đến đường dẫn khí.
Bạch cầu ái toan (eosinophils): Đường dẫn khí của bệnh nhân hen được đặc trưng bởi sự xâm nhập bạch cầu ái toan. Số lượng bạch cầu ái toan đã hoạt hóa trong đường dẫn khí tăng lên khi hít phải dị nguyên. Bạch cầu ái toan gây tăng đáp ứng phế quản thông qua việc tiết các proteins cơ bản và các gốc oxy hóa tự do. Bạch cầu ái toan được huy động đến đường dẫn khí bằng cách chúng bám dính vào tế bào nội mô mạch máu trong hệ tuần hoàn của đường dẫn khí do sự tương tác giữa các phân tử bám dính, di chuyển vào lớp dưới niêm do tác động của các chemokines và sau đó chúng được hoạt hóa và kéo dài thời gian sống còn. Việc ức chế kháng thể chống lại IL-5 làm giảm số lượng bạch cầu ái toan trong máu và trong đàm một cách rõ rệt và kéo dài, nhưng không làm giảm tình trạng tăng đáp ứng phế quản hoặc triệu chứng hen, mặc dù có thể làm giảm số đợt kịch phát ở một số bệnh nhân chọn lọc có tăng bạch cầu ái toan trong đường dẫn khí nhưng kháng corticoid. Bạch cầu ái toan có thể quan trọng trong việc tiết yếu tố tăng trưởng gây tái cấu trúc phế quản và trong các đợt kịch phát. 14
Bạch cầu đa nhân trung tính: Bạch cầu đa nhân trung tính đã hoạt hóa thường tăng lên trong đường dẫn khí và đàm của vài bệnh nhân bị hen nặng, 26 ở bệnh nhân hen hút thuốc lá và trong đợt kịch phát, mặc dù có một số bệnh nhân hen nhẹ hoặc trung bình lại có bạch cầu đa nhân chiếm ưu thế. Tại sao bạch cầu đa nhân trung tính lại kháng với tác dụng kháng viêm của corticoid vẫn chưa được rõ.
Tế bào lympho T: Tế bào lympho T đóng vai trò rất quan trọng trong việc điều hòa đáp ứng viêm ở bệnh nhân hen thông qua việc tiết các cytokines chuyên biệt, từ đó huy động và kéo dài thời gian sống cho bạch cầu ái toan và duy trì số lượng dưỡng bào trong đường dẫn khí.
Đáp ứng miễn dịch loại 1 được điều hòa bởi tế bào lympho T giúp đỡ loại 1 (T H 1). Đáp ứng miễn dịch loại 2 được điều hòa bởi tế bào lympho T giúp đỡ loại 2 (TH2). 21 Đây là 2 loại tế bào thuộc nhóm tế bào lympho T CD4 + . Tế bào T H 1 tiết IL-2, interferon-g (INF-g) và lymphotaxin-α và kích hoạt miễn dịch loại 1 được đặc trưng bởi hoạt động thực bào là chủ yếu. Đáp ứng miễn dịch loại 1 chiếm ưu thế trong đường dẫn khí bình thường hoặc người bị bệnh lao hoặc các bệnh nhiễm trùng khác. Tế bào TH2 tiết IL-4, IL-5 và IL-13 và kích hoạt miễn dịch loại 2 được đặc trưng bởi việc sản xuất kháng thể và tăng bạch cầu ái toan. Tế bào TH2 liên quan đến viêm tăng bạch cầu ái toan thông qua việc tiết IL-5 và tăng IgE thông qua việc tiết IL-4 và IL-13. 15 Đáp ứng miễn dịch loại 2 xuất hiện ở người bị nhiễm giun hoặc bệnh nhân bị bệnh dị ứng hoặc bệnh hen. Đáp ứng miễn dịch loại 2 tại đường dẫn khí thường qua trung gian các tế bào sau: bạch cầu ái toan, bạch cầu ưa kiềm, dưỡng bào, tế bào TH2, tế bào lympho miễn dịch bẩm sinh nhóm 2 và các tế bào lympho B sản xuất IgE. 24
Tế bào T điều hòa (regulatory T cells) đóng vai trò quan trọng trong việc quyết định sự biểu hiện của các tế bào T khác. Tăng hoạt động tế bào TH2 trong hen có thể một phần là do sụt giảm một nhóm tế bào T điều hòa (CD4 + CD25 + ) mà bình thường vẫn có chức năng ức chế tế bào TH2.
Các tế bào cấu trúc đường dẫn khí bao gồm tế bào biểu mô, nguyên bào sợi và tế bào cơ trơn. Các tế bào này là nguồn tiết các hóa chất trung gian gây viêm trong hen. Do số lượng các tế bào cấu trúc nhiều hơn số lượng tế bào viêm, chúng có thể là nguồn tiết hóa chất trung gian chính gây ra viêm mạn tính ở đường dẫn khí trong hen. Hơn nữa, tế bào biểu mô có thể có vai trò chính trong việc chuyển đổi các tín hiệu hít vào từ môi trường thành các đáp ứng viêm và có thể là tế bào đích chính cho điều trị bằng ICS. 3
3.2 Hóa chất trung gian
Nhiều hóa chất trung gian gây viêm liên quan đến hen và chúng có nhiều tác dụng trên đường dẫn khí và gây ra những tổn thương mô bệnh học (Hình 4). 3 Những hóa chất trung gian như histamine, prostaglandin D2 và cysteinyl-leukotrienes gây co thắt cơ trơn phế quản, tăng thoát huyết tương vi mạch, tăng tiết nhầy và huy động các tế bào viêm khác đến đường dẫn khí. Vì mỗi hóa chất trung gian có nhiều tác dụng nên vai trò của từng hóa chất trung gian cụ thể trong sinh bệnh học của hen vẫn chưa rõ.
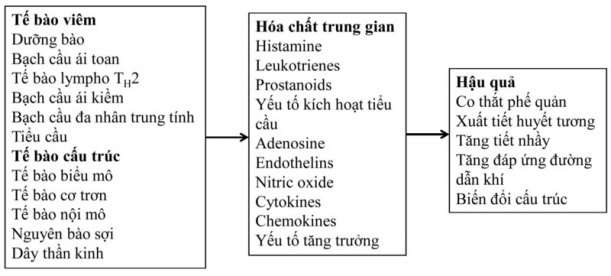
Cytokines: Nhiều loại cytokines điều hòa tình trạng viêm mạn tính của hen. 2 Cytokines xuất phát từ TH2 như IL-4, IL-5 và IL-13 thì điều hòa viêm do dị ứng, trong khi đó các cytokines tiền viêm như IL-1β và TNF-α thì khuếch đại đáp ứng viêm và đóng vai trò quan trọng trong hen nặng.
Chemokines: rất quan trọng trong huy động tế bào viêm vào đường dẫn khí. 17 Eotaxin (CCL11) tương đối chọn lọc cho bạch cầu ái toan, trong khi CCL17 (TARC) và CCL22 (MDC) do tế bào biểu mô tiết ra lại có tác dụng huy động tế bào TH2.
Nitric oxide (NO): được sản xuất bởi vài tế bào trong đường dẫn khí, đặc biệt là tế bào biểu mô và đại thực bào. Nồng độ NO trong hơi thở ra ở bệnh nhân hen cao hơn người bình thường và nó gây ra dãn mạch máu phế quản. NO thở ra đang được dùng để chẩn đoán và theo dõi tình trạng viêm trong hen, bởi vì nó liên quan đến tình trạng viêm tăng bạch cầu ái toan. 20
Cysteinyl leukotrienes: là chất gây co thắt phế quản mạnh và là hóa chất trung gian gây viêm xuất phát chủ yếu từ dưỡng bào và bạch cầu ái toan. Chúng là hóa chất trung gian duy nhất mà việc ức chế chúng dẫn đến cải thiện chức năng phổi và triệu chứng hen. 16
3.3 Tác động của quá trình viêm
Quá trình viêm mạn tính có vài tác động lên các tế bào đích của đường dẫn khí, từ đó gây ra các biến đổi về sinh bệnh học và tái cấu trúc trong hen (Hình 5). Quá trình viêm và sửa chữa diễn ra đồng thời và liên tục trong hen, mặc dù mối liên hệ giữa quá trình viêm mạn tính và triệu chứng hen thường không rõ ràng.
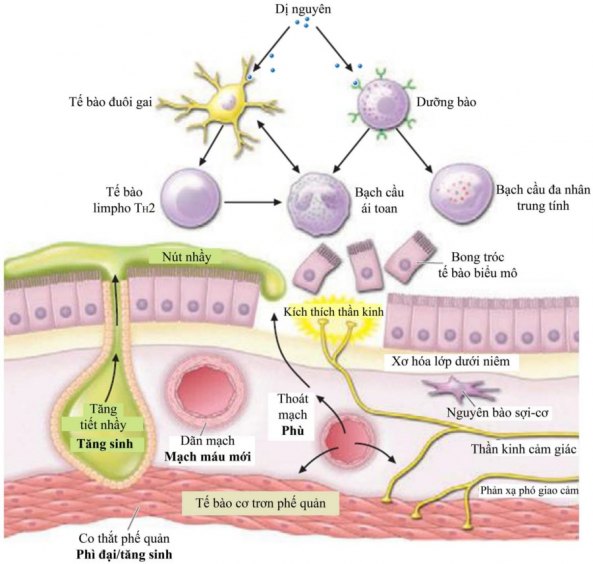
Trên tế bào biểu mô đường dẫn khí:Quá trình viêm trong hen làm cho tế bào biểu mô đường dẫn khí bở và dễ bị bong tróc. Bong tróc tế bào biểu mô có thể góp phần gây tăng đáp ứng đường dẫn khí bằng vài cách sau: mất chức năng ngăn cản không cho kháng nguyên xuyên qua, mất các enzymes có khả năng phân hủy một số hóa chất trung gian gây viêm nhất định, mất yếu tố thư giãn cơ và bộc lộ đầu tận cùng dây thần kinh cảm giác từ đó gây ra phản xạ thần kinh của đường dẫn khí. Việc tiếp xúc với khí ozone, nhiễm virus, hóa chất nhạy cảm và dị nguyên có thể gây tăng đáp ứng đường dẫn khí vì tất cả các yếu tố kích thích này có thể làm tổn hại tế bào biểu mô.
Gây xơ hóa: Ở tất cả bệnh nhân hen, việc lắng đọng collagen loại III và V ngay dưới màng nền gây xơ hóa lớp dưới niêm và làm dầy màng nền. Ở những bệnh nhân hen nặng hơn, xơ hóa xảy ra ở cả thành đường dẫn khí và có thể gây ra hẹp đường dẫn khí không hồi phục.
Cơ trơn đường dẫn khí: Ở bệnh nhân hen, thụ thể β có thể bị trơ với bằng chứng là cơ trơn giảm đáp ứng với thuốc kích thích β dù số lượng thụ thể β vẫn không giảm. Bất thường này có thể là hậu quả của quá trình viêm mạn tính. Các hóa chất trung gian gây viêm làm biến đổi các kênh ion, đây là những kênh có khả năng điều hòa điện thế màng tế bào cơ trơn, do đó làm thay đổi tính hưng phấn của những tế bào này. Ở bệnh nhân hen còn có tình trạng phì đại và tăng sản tế bào cơ trơn. 12 Đây có thể là hậu quả của việc kích thích tế bào cơ trơn do các yếu tố tăng trưởng khác nhau như yếu tố tăng trưởng tiểu cầu hoặc endothelin-1 được tiết ra bởi tế bào viêm hoặc tế bào biểu mô.
Đáp ứng tuần hoàn: Ở bệnh nhân hen, lưu lượng tuần hoàn niêm mạc phế quản tăng lên nên có thể góp phần làm hẹp lòng phế quản. Số lượng mạch máu ở đường dẫn khí cũng tăng lên do có hiện tượng tăng sản mạch máu khi đáp ứng với các yếu tố tăng trưởng, đặc biệt yếu tố tăng trưởng nội mô mạch máu. Hiện tượng thoát huyết tương từ các tiểu tĩnh mạch sau mao mạch khi đáp ứng với các hóa chất gây viêm gây ra phù nề đường dẫn khí và thoát huyết tương vào lòng phế quản.
Tăng tiết nhầy: Tăng tiết nhầy góp phần hình thành các nút nhầy dính gây bít tắc phế quản, đặc biệt trong hen ác tính. Có hiện tượng tăng sản tuyến dưới niêm mạc ở đường dẫn khí lớn và tăng số lượng tế bào đài trong niêm mạc của tất cả đường dẫn khí. Các hiện tượng này có thể do IL-13 gây ra.
Điều hòa thần kinh: Những khiếm khuyết trong cơ chế điều hòa thần kinh tự chủ có thể góp phần gây tăng đáp ứng đường dẫn khí, nhưng những khiếm khuyết này có thể là hậu quả của bệnh hen hơn là khiếm khuyết nguyên phát. Phản xạ phó giao cảm, thông qua sự phóng thích acetylcholine tác động lên các thụ thể muscarinic gây co thắt phế quản, có thể bị kích hoạt trong hen. Các hóa chất trung gian gây viêm có thể kích hoạt dây thần kinh cảm giác, gây ra phản xạ phó giao cảm với tình trạng co thắt phế quản hoặc tiết ra các neuropeptides viêm. Các sản phẩm viêm có thể kích thích đầu dây thần kinh cảm giác trong lớp niêm mạc đường dẫn khí và làm dây thần kinh trở nên tăng nhạy cảm. Dây thần kinh của đường dẫn khí cũng có thể tiết ra các chất dẫn truyền thần kinh, như chất P, có tác dụng gây viêm.
Tài liệu tham khảo
1 Akbari O, Faul JL, Hoyte EG, et al. CD4+ invariant T-cell-receptor+ natural killer T cells in bronchial asthma. N Engl J Med 2006;354:1117-1129
2 Barnes PJ. Cytokine modulators as novel therapies for asthma. Annu Rev Pharmacol Toxicol 2002;42:81-98
3 Barnes PJ. Asthma. In: Kasper DL, Hauser SL, Jameson JL, et al., eds. Harrison’s Principles of Internal Medicine. New York: McGraw-Hill Education, 2015; 1669-1681
4 Bumbacea D, Campbell D, Nguyen L, et al. Parameters associated with persistent airflow obstruction in chronic severe asthma. Eur Respir J 2004;24:122-128
5 Busse WW, Lemanske RF, Jr. Asthma. N Engl J Med 2001;344:350-362
6 Calhoun WJ. Nocturnal asthma. Chest 2003;123:399S-405S
7 Cohn L, Elias JA, Chupp GL. Asthma: mechanisms of disease persistence and progression. Annu Rev Immunol 2004;22:789-815
8 Fahy JV. Type 2 inflammation in asthma–present in most, absent in many. Nat Rev Immunol 2015;15:57-65
9 Galli SJ, Kalesnikoff J, Grimbaldeston MA, et al. Mast cells as “tunable” effector and immunoregulatory cells: recent advances. Annu Rev Immunol 2005;23:749-786
10 Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention (updated 2010). Available at: http://www.ginasthma.org/. Accessed: 11 April 2015
11 Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention (updated 2015). Available at: http://www.ginasthma.org/. Accessed: 13 April 2015
12 Hirst SJ, Martin JG, Bonacci JV, et al. Proliferative aspects of airway smooth muscle. J Allergy Clin Immunol 2004;114:S2-17
13 James A. Airway remodeling in asthma. Curr Opin Pulm Med 2005;11:1-6
14 Kay AB, Phipps S, Robinson DS. A role for eosinophils in airway remodelling in asthma. Trends Immunol 2004;25:477-482
15 Kay AB. The role of T lymphocytes in asthma. Chem Immunol Allergy 2006;91:59-75
16 Leff AR. Regulation of leukotrienes in the management of asthma: biology and clinical therapy. Annu Rev Med 2001;52:1-14
17 Miller AL, Lukacs NW. Chemokine receptors: understanding their role in asthmatic disease. Immunol Allergy Clin North Am 2004;24:667-683, vii
18 Peters-Golden M. The alveolar macrophage: the forgotten cell in asthma. Am J Respir Cell Mol Biol 2004;31:3-7
19 Robinson DS. The role of the mast cell in asthma: induction of airway hyperresponsiveness by interaction with smooth muscle? J Allergy Clin Immunol 2004;114:58-65
20 Smith AD, Taylor DR. Is exhaled nitric oxide measurement a useful clinical test in asthma? Curr Opin Allergy Clin Immunol 2005;5:49-56
21 Spellberg B, Edwards JE, Jr. Type 1/Type 2 immunity in infectious diseases. Clin Infect Dis 2001;32:76-102
22 Tan WC. Viruses in asthma exacerbations. Curr Opin Pulm Med 2005;11:21-26
23 Thomson NC, Chaudhuri R, Livingston E. Asthma and cigarette smoking. Eur Respir J 2004;24:822-833
24 Voehringer D, Reese TA, Huang X, et al. Type 2 immunity is controlled by IL- 4/IL-13 expression in hematopoietic non-eosinophil cells of the innate immune system. J Exp Med 2006;203:1435-1446
25 Wadsworth S, Sin D, Dorscheid D. Clinical update on the use of biomarkers of airway inflammation in the management of asthma. J Asthma Allergy 2011;4:77-86
26 Wenzel S. Mechanisms of severe asthma. Clin Exp Allergy 2003;33:1622-1628









