️ Sổ tay Hướng dẫn thực hành tiêm chủng vắc xin phòng COVID-19 (vắc xin phòng COVID-19 Moderna) (P4)
Phụ lục 4
(Ban hành kèm theo văn bản số 1734/ BYT-DP ngày 17/03/2021)

Phụ lục 5
(Ban hành kèm theo Quyết định số 1734/QĐ-BYT ngày 17/03/2021)
Mẫu
BÁO CÁO HÀNG NGÀY KẾT QUẢ TRIỂN KHAI KẾ HOẠCH TIÊM CHỦNG VẮC XIN COVID-19
(Dành cho cơ sở thực hiện tiêm chủng báo cáo)
Tỉnh/TP.............................. Quận/huyện ............................
Cơ sở tiêm chủng...............
Tổng số đối tượng đăng kí tiêm chủng: .........., Ngày ......../......./........

Ghi chú: Nếu 1 cơ sở tổ chức tiêm cho nhiều đơn vị thì sử dụng bảng dưới đây:
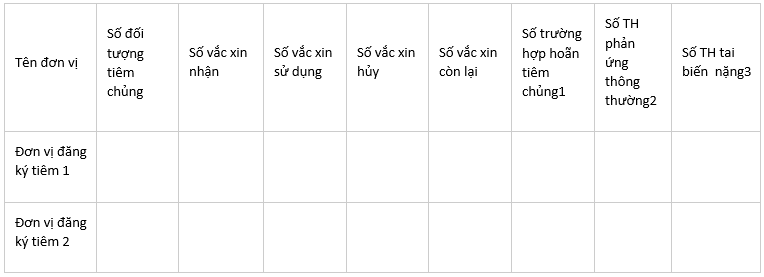
Báo cáo trường hợp hoãn tiêm chủng
Số trường hợp hoãn tiêm: .......................
Lý do khác:................................................
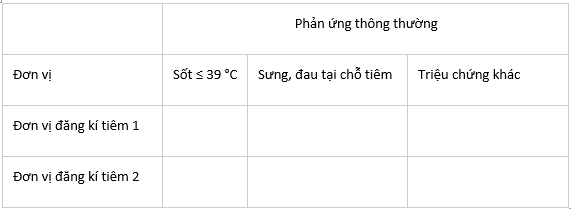
Báo cáo cụ thể các trường hợp phản ứng thông thường
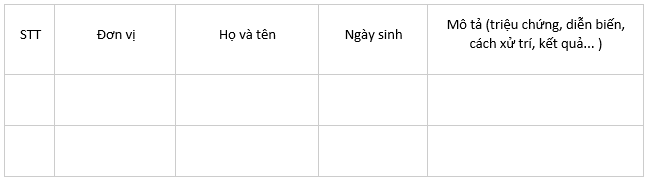
Báo cáo trường hợp tai biến nặng sau tiêm chủng:
Liệt kê các trường hợp và mô tả ngắn gọn từng trường hợp:
Từng trường hợp được báo cáo chi tiết theo phiếu điều tra tai biến nặng sau tiêm chủng tại thông tư 34/2018/TT – BYT ngày 12 tháng 11 năm 2018.
Ngày ...........tháng ........năm 2021

Phụ lục 6: BÁO CÁO TỔNG HỢP HÀNG NGÀY CỦA TUYẾN TỈNH

TỔNG HỢP BÁO CÁO HÀNG NGÀY KẾT QUẢ TRIỂN KHAI TIÊM CHỦNG VẮC XIN PHÒNG COVID-19
Thời gian bắt đầu triển khai: Ngày ......../....../2021
Ngày báo cáo: ….../…...../2021

*: Đợt tiêm: Tính theo Quyết định của Bộ Y tế (Đơt 5: QĐ 2971/QĐ-BYT ngày 17/6/2021; Đợt 6: QĐ 3020/QĐ-BYT ngày 23/6/2021)
**: Số vắc xin sử dụng nguyên lọ (liều) (VD1: lọ vắc xin 10 liều đã mở, sử dụng để tiêm chủng cho 9 người, còn 1 liều trong lọ sau buổi tiêm chủng thì số sử dụng báo cáo là 10 liều. VD2: lọ vắc xin 10 liều đã mở, sử dụng để tiêm chủng cho 11 người thì số sử dụng báo cáo là 10 liều)
***: Số ca phản ứng nhẹ được ghi nhận trong ngày nhưng có thể bao gồm các ca được tiêm chủng trước ngày báo cáo. Một người có nhiều triệu chứng chỉ ghi nhận 1 trường hợp ở cột này
****: Trường hợp xác định là phản ứng nặng thì bắt buộc phải có thông tin báo cáo để nhập vào danh sách "PL 2". Đề nghị Hội đồng chuyên môn cấp tỉnh tổ chức họp và đánh giá, xác định, phân loại ca phản ứng sớm trong vòng 5 ngày kể từ khi nhận báo cáo theo quy định.

Phụ lục 7: TỔNG HỢP BIẾN CỐ BẤT LỢI CỦA TUYẾN TỈNH
Phụ lục 2:

TỔNG HỢP BÁO CÁO HÀNG NGÀY TRƯỜNG HỢP TAI BIẾN NẶNG SAU TIÊM CHỦNG VẮC XIN PHÒNG COVID-19
Thời gian bắt đầu triển khai: Ngày ……../…….../2021
Ngày báo cáo: …....../…......./2020


Phụ lục 8:

Ngày tháng năm 2021
BÁO CÁO KẾT QUẢ TRIỂN KHAI TIÊM CHỦNG VẮC XIN PHÒNG COVID-19
ĐỢT ……..
I.KẾT QUẢ
Kết quả chung:
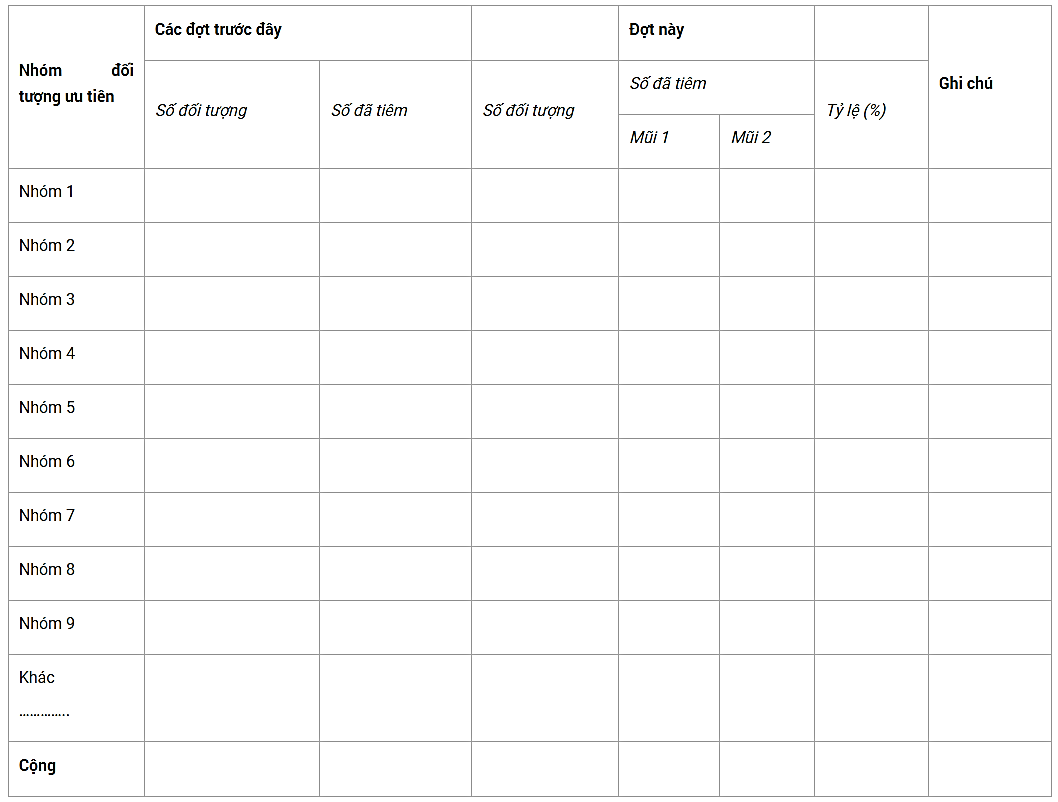
Kết quả theo đơn vị:
II.PHẢN ỨNG SAU TIÊM VẮC XIN PHÒNG COVID - 19.

III.TỔ CHỨC THỰC HIỆN
1.Công tác chỉ đạo
-
-
-
2.Tổ chức thực hiện
2.1. Thời gian triển khai
Thời gian chung triển khai trên địa bàn: Từ ngày … tháng … năm 2021 đến ngày … tháng … năm 2021
Tổng số điểm tiêm chủng: ……….., trong đó:
Số điểm tiêm chủng tại trạm: ……..;
Số điểm tiêm chủng tại Bệnh viện: ……..;
Số điểm tiêm chủng lưu động: …..…; -
Số cơ sở tiêm chủng:
Bệnh viện tuyến TW/Khu vực/Tỉnh/Bộ ngành/ĐHY: ……. cơ sở;
Bệnh viện/Trung tâm Y tế huyện …………. cơ sở;
Phòng khám đa khoa… …………. cơ sở;
Trạm Y tế …………. cơ sở;
Cơ sở tiêm chủng dịch vụ …………. cơ sở;
Cơ sở khám chữa bệnh tư nhân …………. cơ sở; o
Điểm tiêm chủng lưu động …………. cơ sở;
Khác (ghi rõ)…………………………………..………...…. cơ sở;
2.2. Hoạt động truyền thông

2.3. Cung cấp vắc xin, vật tư
*: Số liều vắc xin đã tiêm cho đối tượng và số liều còn lại trong các lọ đã mở nhưng không sử dụng hết được tính vào số sử dụng.
2.4. Kinh phí
2.5. Công tác giám sát và nhân lực triển khai
a.Công tác giám sát
Tuyến tỉnh: Số lượt giám sát: ………lượt; Số người giám sát: ……. người; số điểm giám sát: ……. điểm
Tuyến huyện: Số lượt giám sát: ……. lượt; Số người giám sát: …… người; số điểm giám sát: …….. điểm
Các vấn đề phát hiện trong quá trình giám sát:
+
+
+
Các vấn đề đã được giải quyết:
+
+
+
b.Nhân lực trực tiếp tham gia
IV.NHỮNG THUẬN LỢI VÀ KHÓ KHĂN
Thuận lợi
-
-
-
Khó khăn
-
-
-
V.NHẬN XÉT VÀ ĐỀ NGHỊ
-
-
-

PHỤ LỤC 9:
Bảng kiểm an toàn tiêm chủng vắc xin phòng COVID-19
(Theo phụ lục văn bản số 5488/BYT-KCB ngày 09/7/2021)

TÀI LIỆU THAM KHẢO
Chính phủ Việt Nam (2021) Nghị quyết số 21/NQ-CP ngày 26 tháng 02 năm 2021 của Thủ tướng Chính phủ về mua và sử dụng vắc xin phòng COVID-19.
Chính phủ Việt Nam (2017) Nghị định số 104/NĐ-CP ngày 1/7/2016 của Thủ tướng Chính phủ qui định về hoạt động tiêm chủng.
Chính phủ Việt Nam (2018) Nghị định 155/2018/NĐ-CP ngày 12/11/2018 sửa đổi bổ sung một số qui định của Nghị định 104/NĐ-CP ngày 1/7/2016.
Bộ Y tế (2021), Quyết định số 3355/QĐ-BYT ngày 08 tháng 07 năm 2021 về việc phê duyệt kế hoạch triển khai chiến dịch tiêm vắc xin phòng COVID-19 năm 20212022.
Bộ Y tế (2021), Quyết định số 1464/QĐ-BYT ngày 05 tháng 03 năm 2021 về việc ban hành Hướng dẫn tiếp nhận, bảo quản, phân phối và sử dụng vắc xin phòng COVID-19.
Bộ Y tế (2021), Văn bản số 1734/BYT-DP ngày 17/3/2021 Hướng dẫn tổ chức buổi tiêm chủng vắc xin phòng COVID-19
Bộ Y tế (2021), Quyết định số 2995/QD-BYT ngày 18/6/2021 Hướng dẫn tạm thời Khám sàng lọc trước tiêm chủng vắc xin phòng COVID-19.
Bộ Y tế (2021), Quyết định số 3445/QD-BYT ngày 15/7/2021 Hướng dẫn sửa đổi, bổ sung Hướng dẫn tạm thời khám sàng lọc trước tiêm chủng vắc xin phòng COVID-19.
Bộ Y tế (2021), Quyết đinh số 1966/QĐ-BYT ngày 22/4/2021 về Hướng dẫn chẩn đoán và điều trị Hội chứng giảm tiểu cầu, huyết khối sau tiêm vắc xin phòng COVID-19
Văn bản số 3886/BYT-DP ngày 11/05/2021 “Hướng dẫn giám sát sự cố bất lợi sau tiêm vắc xin phòng COVID-19”
Văn bản số 4198/BYT-KCB ngày 22/05/2021 về việc Triển khai công tác an toàn tiêm chủng vắc xin phòng COVID-19”
Quyết định 3348/QĐ-BYT ngày 08/7/2021 Hướng dẫn chẩn đoán và điều trị viêm cơ tim sau tiêm chủng vắc xin phòng COVID-19
Văn bản số 5488/BYT-KCB ngày 09/7/2021 về Hướng dẫn đảm bảo an toàn tiêm chủng vắc xin phòng COVID-19
Bộ Y tế (2020) Thông tư 24/2018/TT-BYT ngày 18/9/2018 và Thông tư 05/TTBYT ngày 3/4/2020 qui định về tổ chức hoạt động của Hội đồng Tư vấn chuyên môn đánh giá tai biến nặng sau tiêm chủng.
Bộ Y tế (2017), Thông tư 34/2018/TT-BYT ngày 12/11/2018 qui định một số điều của Nghị định 104/NĐ-CP ngày 1/7/2016.
Bộ Y tế (2017), Thông tư 51/2017/TT-BYT ngày 29 tháng 12 năm 2017 Hướng dẫn phòng, chẩn đoán, xử trí phản vệ.
Dự án Tiêm chủng mở rộng Quốc gia (2017), Thực hành tiêm chủng, Tài liệu hướng dẫn cán bộ y tế (dựa theo hướng dẫn của Tổ chức Y tế Thế giới).
Thông tin từ US CDC https://vietnamese.cdc.gov/coronavirus/2019ncov/vaccines/different-vaccines/Pfizer-BioNTech.html
COVID-19 mRNA Vaccines – Immunization Action Coalition • Saint Paul, Minnesota • 651-647-9009 www.vaccineinformation.org
Fact sheet for healthcare providers administering vaccine (vaccination providers) emergency use authorization (EUA) of the Moderna COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19) updated 24 June 2021.
Extraordinary meeting of the Strategic Advisory Group of Experts on Immunization (SAGE) - 21 January 2021. Geneva: World Health Organization; 2021
WHO Prequalification - Guidance Document 23 April 2021; Status of COVID-19 Vaccines within WHO EUL/PQ evaluation process
World Health Organization, Interim recommendations for use of the Moderna mRNA-1273 vaccine against COVID-19, First issued 25 January 2021, Updated 15 June 2021.
Hill EM, Keeling MJ. Comparison between one and two dose SARS-CoV-2 vaccine prioritisation for a fixed number of vaccine doses.
Moghadas SM, Vilches TN, Zhang K, Nourbakhsh S, Sah P, Fitzpatrick MC et al. Evaluation of COVID-19 vaccination strategies with a delayed second dose.
Nam A, Ximenes R, Yeung MW, Mishra S, Wu J, Tunis M et al. Modelling the impact of extending dose intervals for COVID-19 vaccines in Canada.
Matrajt L, Eaton J, Leung T, Dimitrov D, Schiffer JT, Swan DA et al. Optimizing vaccine allocation for COVID-19 vaccines: potential role of single-dose vaccination.
Doria-Rose N, Suthar MS, Makowski M, O’Connell S, McDermott AB, Flach B et al. Antibody Persistence through 6 Months after the Second Dose of mRNA-1273 Vaccine for Covid-19. New England Journal of Medicine.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









