️ 5 chữ 'R' trong xạ trị
Mặc dù Regaud bắt đầu các nghiên cứu phân liều xạ đầu tiên- bác sĩ xạ trị ung thư đầu tiên-Grubbe, đã điều trị cho một bệnh nhân ung thư vú (Bà Rosa Lee) bằng xạ trị trong 1 giờ mỗi ngày trong 18 ngày vào năm 1896. Ông đã tìm thấy những đáp ứng có lợi, nhưng đã không công bố chúng bởi vì anh ta chỉ là một sinh viên y khoa .Tuy nhiên, Grubbe đã xuất bản hai bài báo khoa học 50 năm sau khi lần đầu tiên sử dụng xạ trị.
Coutard, một đồng nghiệp của Regaud, đã áp dụng phương pháp phân liều xạ trị cho bệnh ung thư đầu và cổ vào năm 1934 và thu được kết quả thành công. Ông nhấn mạnh tầm quan trọng của khái niệm liều -thời gian (time-dose) trong xạ trị (Hình 1)
Coutard đã quan sát thấy rằng các phản ứng da và niêm mạc nhìn thấy trong quá trình xạ trị ung thư vòm họng và thanh quản phụ thuộc vào liều lượng và thời gian xạ trị. Do đó phân liều xạ trị được thành lập dựa trên 5 tiêu chí chính:
- Tái lập dân số tế bào (Repopulation)
- Sửa chữa các tổn thương (Repair)
- Tái sắp xếp các tế bào vào các pha của chu kỳ tế bào (Redistribution= Reassortment)
- Tái phân bố oxy (Reoxygenation)
- Nhạy xạ (Radiosensitivity)
Các yếu tố sinh học ảnh hưởng đến đáp ứng của các mô bình thường và khối u trong phân liều xạ trị đã được xác định là sửa chữa, tái sắp xếp (tái phân phối), tái lập dân số tế bào và tái phân bố oxy bởi Withers vào năm 1975. Chữ “R” thứ 5 là nhạy xạ (Radiosensitivity) được thêm vào danh sách này vào năm 1981 bởi Fertil . Tất cả những điều này rất quan trọng để ước tính đáp ứng của các mô bình thường hoặc khối u đối với xạ trị.
1. Tái lập dân số tế bào (Repopulation)
Cả khối u và tế bào bình thường vẫn tiếp tục tăng sinh ngay cả khi chúng tiếp xúc với bức xạ. Sự tăng sinh này là một đáp ứng sinh lý của khối u và các mô bình thường đối với sự giảm số lượng tế bào. Hệ quả của sự tăng số lượng tế bào là:
- Tăng số lượng của những tế bào bướu đã bị phá huỷ -> kháng trị
- Tăng số lượng của những tế bào mô lành bình thường -> có lợi cho việc điều trị
Các tế bào nghỉ ngơi trong pha G0 bước vào chu kỳ tế bào để bù đắp cho các tế bào bị tiêu diệt bởi xạ trị và chúng trải qua quá trình nguyên phân → tái sinh. Các mô đáp ứng sớm tái tạo nhanh hơn khối u trong thời gian giữa các phân liều.
Nếu tổng thời gian điều trị tổng dài hơn thời gian cần thiết, khối u sẽ chuyển sang chế độ tăng tốc tái lập dân số (Accelerated repopulation) và đáp sẽ ứng của nó đối với bức xạ sẽ giảm do sự tăng sinh của khối u.
Xạ trị phải được hoàn thành càng sớm càng tốt-trong giới hạn dung nạp liều về phản ứng cấp của mô lành- do nguy cơ tái phát nhanh
Sự tăng tốc tái lập dân số tế bào bắt đầu sau 28 ngày điều trị của khối u đầu cổ
2. Sửa chữa các tổn thương (Repair)
Xạ trị là nguyên nhân làm tổn thương gây chết cho các tế bào khối u và tổn thương dưới mức gây chết (Sublethal damge: SLD) trong các mô bình thường. Việc áp dụng sự phân liều trong xạ trị cho phép các mô bình thường có thời gian để sửa chữa.
Nếu một khoảng thời gian tối ưu giữa các phân liều (6 -12 h), các tế bào mô lành đáp ứng muộn với bức xạ có khả năng sửa chữa nhanh hơn các tế bào khối u. Theo giả thuyết tấn công đa mục tiêu- đơn ( Multiple target-single hit theory) , Tổn thương dưới mức gây chết (SLD )xảy ra trong các tế bào động vật có vú ở liều thấp và tổn thương này được sửa chữa trong các khoảng thời gian giữa các phân liều
Việc sửa chữa tổn thương dưới mức gây chết (SLD) ở tủy sống chậm hơn nhiều so với các mô bình thường khác. Vì vậy, khoảng thời gian giữa các phân liều nên có ít nhất 8 h trong chiếu xạ tủy sống.
Sửa chữa tổn thương dưới mức gây chết (SLD) của tế bào khối u bắt đầu tại điểm ban đầu của lề (Dq) trong đường cong sống còn của mô hình bậc 2 tuyến tính (LD) ). Phân liều tiếp theo sẽ ngăn chặn sự sửa chữa dưới mức này, sự di chuyển liều ra khỏi lề. Mặt khác, các tế bào mô bình thường bắt đầu sửa chữa những tổn thương dưới mức gây chết (SLD) trước Dq và do đó không bị ảnh hưởng bởi việc phân liều. Tái tạo và sửa chữa → quan trọng hơn đối với các mô bình thường so với các mô khối u.
Khi sự bảo vệ của các mô bình thường tăng lên, độ kháng xạ tăng lên.
Tái phân phối ( tái sắp xếp) và tái oxy hóa → quan trọng hơn đối với các mô khối u so với các mô bình thường; khi nhiều mô khối u chết đi, độ nhạy của nó tăng lên.
Khi tổng liều xạ được áp dụng bằng cách chia nó thành các phân liều nhỏ và nếu khoảng cách giữa hai phân liều số đủ dài (> 6 h), Có thể bảo vệ các mô lành khỏi tác hại của bức xạ thông qua sửa chữa các tổn thương dưới mức gây chết (SLD) và tái lập dân số tế bào.
3. Tái phân bố hay là tái xắp sếp ( Redistibution = Reassortment)
Độ nhạy xạ của các tế bào thay đổi theo pha của chu kỳ tế bào. Các pha nhạy nhất là M và G2, trong khi kháng xạ nhất là pha S. Các tế bào trong các pha kháng xạ của chu kỳ tế bào có thể đi vào pha nhạy xạ ở những phân liều tiếp theo. Do đó, xác suất các tế bào khối u sẽ tiếp xúc với bức xạ trong giai đoạn nhạy xạ tăng lên và xác suất này sẽ tiếp tục tăng trong suốt quá trình điều trị, và do đó lợi ích của xạ trị cũng sẽ tăng lên.
Thời gian các pha trong chu kỳ tế bào: G1 = 1,5 - 14h, S = 6 - 9 h, G2 = 1 - 5h, M = 0,5- 1h
- Nhạy xạ nhất: pha M và G2
- Kháng xạ nhất : pha S
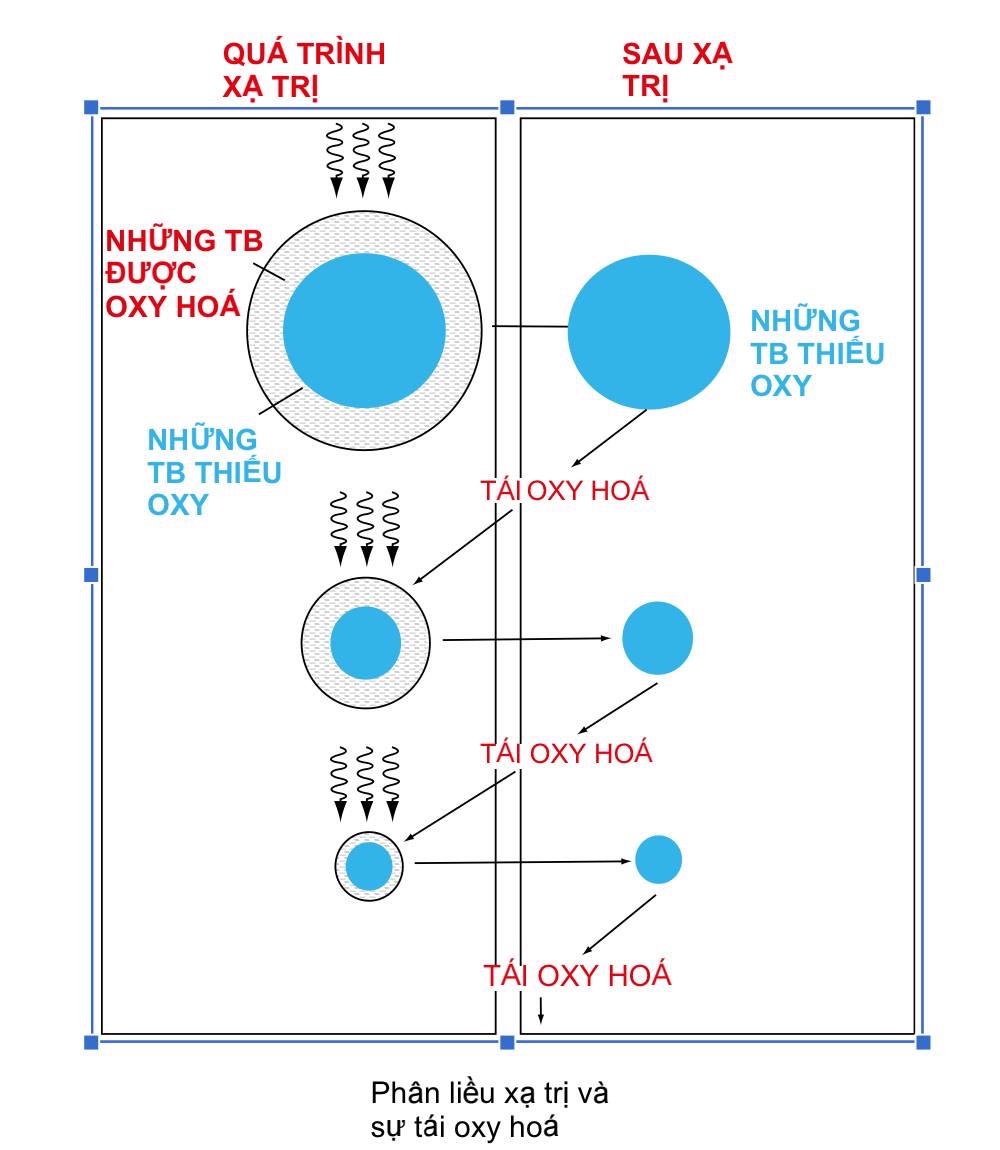
4. Tái phân bố oxy ( Reoxygenation)
Khi thể tích khối u tăng lên thông qua sự tăng sinh của các tế bào, mạch máu của mô khối u cũng trở nên không đủ để đáp ứng yêu cầu dinh dưỡng của nó, và các vùng hoại tử do thiếu oxy (hypoxi- necrotic) bắt đầu xảy ra trong mô khối u . Các tế bào thiếu oxy có khả năng kháng bức xạ cao gấp 2 - 3 lần (→ cần có oxy để tác động gián tiếp xảy ra). Các tế bào được oxy hóa tốt sẽ nhạy xạ hơn và sẽ bị chết trong toàn bộ quá trình xạ trị. Do đó, do việc cung cấp oxy là phải đầy đủ, các tế bào thiếu oxy dần dần có được máu và được oxy hoá tốt hơn, và độ nhạy xạ của chúng tăng lên.
Oxy hoá một khối u từ trạng thái thiếu oxy
- Nếu huyết sắc tố (Hb) thấp, có thể truyền máu.
- Oxy áp lực cao hoặc carbogen có thể được áp dụng trong quá trình xạ trị.
- Bệnh nhân có thể được ngăn cản việc sử dụng các chất gây giảm oxy như thuốc lá trong thời gian xạ trị.
- Có thể sử dụng chất làm nhạy xạ trong môi trường thiếu oxy (ví dụ, metronidazole).
5. Nhạy xạ ( Radiosensitivity)
Độ nhạy xạ ( là chữ “R” thứ năm của xạ trị) là một khái niệm liên quan đến nhiều thành phần. Độ nhạy xạ có thể bị ảnh hưởng bởi các điều kiện môi trường. Thuật ngữ “nhạy xạ” được định nghĩa lần đầu tiên bởi Bergonie và Tribendau vào năm 1907; họ cho rằng độ nhạy xạ tỷ lệ thuận với sự phân bào và tỷ lệ nghịch với độ biệt hoá. Do độ nhạy xạ có thể bị ảnh hưởng bởi các điều kiện bên ngoài, thuật ngữ SF2đã được đưa ra bởi Waste vào năm 1981.
SF2 = phần tế bào sống sót sau khi dùng liều xạ 2 Gy. Khi SF2 tăng, độ nhạy xạ giảm.
SF2 được biểu thị bằng đồ họa cho một số dòng tế bào khối u
Chất gây nhạy xạ được sử dụng để giảm SF2.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









