️ Chuyển gen kháng thuốc- một chiến lược kháng u (P2)
ÁP DỤNG CHUYỂN GEN KHÁNG THUỐC ĐỂ NÂNG CAO TRỊ LIỆU KHÁNG U
Một trong những mục đích chính của việc chuyển gen kháng thuốc là nâng cao sự dung nạp liều trong cơ thể, tức là làm giảm độc tính tại liều hiện hữu (existent dose) của hóa trị kháng u hoặc cho phép tăng cường liều. Mặc dầu đã hoàn tất nhiều thí nghiệm trên động vật chứng minh có sự giảm độc tính sau khi chuyển gen kháng thuốc, nhưng những nghiên cứu nhằm test khả năng áp dụng của nó trong việc nâng cao tính kháng thuốc để cải thiện hơn nữa hiệu quả trị liệu kháng u thì vẫn còn hạn chế.
Zhao và cộng tác đã chứng minh là có thể nâng cao được khả năng tồn tại của chuột có mang các khối u vú EO771 được cấy ghép với tủy đã được tiếp cận biến thể serin - 31.DHFR retrovirus rồi sau đó được xử lý với MTX. Hanania và Deisseroth đã chứng minh sự hiệu quả hơn của việc xử lý Taxol với các khối u vú 11A1 được tải nạp với vec tơ nhạy cảm hóa học p53 ở chuột được ghép tủy tải nạp MDR. Hiệu quả của AGT thể đột biến đối với việc nâng cao hiệu quả hóa trị khối u đã được test bởi Koç và cộng tác trong mô hình ghép ngoại lai ung thư kết tràng người SW460 ở chuột được ghép tủy tải nạp với AGT thể đột biến G156A. Khi quay vòng nhiều lần với BG và BCNU thì sẽ chọn lọc được tủy G156A tải nạp và cuối cùng sẽ nâng cao được sự dung nạp thuốc ở chuột và làm chậm lại đáng kể sự tăng trưởng u ở liều cao của BG + BCNU, đó là liều chí tử đối với chuột không có tủy G156A.
Các nhà khoa học đã sử dụng liều dung nạp tăng với mức có thể dự đoán được ở các đối tượng nhận tủy chuyển gen L22Y DHFR để test khả năng ứng dụng nó trong điều trị một số khối u có tính nhạy cảm antifolate khác nhau. Trong hệ thống này, không phát hiện thấy liều MTX tăng dần kháng lại một cách hiệu ứng bệnh bạch cầu tủy mạn tính (CML) trong mô hình chuột 32Dp210. Trên thực tế, MTX còn gây hại hơn cả sự sinh u. Tuy nhiên, nếu sử dụng trimetrexat liều cao hơn thì sẽ làm chậm lại đáng kể sự khởi phát u và các khối u không nảy sinh nữa khi trimetrexat được phân phối đồng thời với một tiền thuốc ức chế vận chuyển nucleosid có tên là nitrobezylmercaptopurin-robosid phosphat (NBMPR-P), chất này ức chế sự cứu hộ thymine và cácònucleosid của purin vì vậy mà làm tăng hiệu lực antifolat. Mặc dầu sau khi ngừng thuốc các khối u vẫn xuất hiện, nhưng những thí nghiệm này đã chứng minh được tính hữu dụng tiềm tàng của MTX kháng lại antifolate khi phân phối tăng liều một cách hợp lý do có sự biểu hiện của DHFR kháng thuốc. Vì vậy việc kết hợp cùng với antisense nhắm vào điểm dừng của BCR/ABC oncogene trong CML đang được Trường Đại học Minnesota khai thác như một cách tiếp cận trị liệu.
Các nhà khoa học cũng thiết lập một loại ung thư vú FVB/N (FVB/N mammary carcinoma –FMC) – một dạng ung thư vú mới tồn tại như một dòng khối u dưới da có thể cấy ghép được ở chuột FVB/N để thử nghiệm về sự kết hợp với hệ thống ghép đồng thuận như đã mô tả với việc sử dụng tủy chuyển gen DHFR. Khối u FMC không bộc lộ sự nhạy cảm đáng kể đối với MTX ngay cả ở cácònồng độ cao hơn mà ở đó đã đạt được trong các động vật được ghép tủy chuyển gen hoặc trong các động vật chuyển gen DHFR. Tuy nhiên người ta đã quan sát thấy có nâng cao về hoạt tính kháng u khi động vật được xử lý với trimetrexat, đặc biệt khi được phân phối đồng thời với NBMPR-P. Với công trình về các khối u 32Dp210 và FMC thì rõ ràng là với các khối u không thể hiện tính nhạy cảm với MTX thì việc sử dụng một antifolat luân phiên như trimetrexat kết hợp cùng với một chất ức chế vận chuyển nucleosid thì có thể đây là một cách tiếp cận kháng u hiệu quả, đặc biệt khi áp dụng một chế độ trị liệu mạnh mẽ hơn để biểu hiện được DHFR kháng thuốc. Có thể dự đoán được rằng tăng dần liều MTX tăng dần sẽ làm tăng hiệu ứng kháng lại các khối u có tính nhạy cảm lớn hơn với thuốc này. Các nghiên cứu kiểu này hiện đang được thực hiện trong hệ mô hình chuyển gen.
SỰ CHỌN LỌC IN VIVO CỦA TẾ BÀO BIỂU HIỆN GEN KHÁNG THUỐC
Việc dự đoán hiệu quả của chuyển gen vào trong tế bào tạo máu hiện nay còn bị hạn chế là do hiệu quả của nó đối với các động vật lớn và người. Tuy nhiên cũng có nhiều hy vọng trong việc nâng cao hiệu quả của chuyển gen thông qua việc sử dụng các vec tơ xen kẽ (alteRNAte vector) như các vec tơ lentivirus hay vec tơ foamy virus hoặc thông qua sự tiếp xúc và các quy trình xử lý tế bào. Một cách tiếp cận khác làm tăng sự trình diện các tế bào tải nạp trong tuần hoàn là sự chọn lọc in vivo thông qua việc ứng dụng chọn lọc dược lý học.
Trong các nghiên cứu độc lập ở hệ MDR, Sorrentino và cộng sự, Podda và cộng sự thấy có sự tăng các tế bào bạch cầu máu ngoại vi tải nạp MDR sau khi được xử lý với Taxol, do vậy đã chứng minh được tính hữu dụng của việc chọn lọc thuốc để làm tăng sự trình diện của các tế bào biểu hiện gen kháng thuốc. Tuy nhiên, sự chọn lọc ở mức các tế bào gốc tạo máu có khả năng ghép dài hạn ổn định thì vẫn chưa được chứng minh trong các nghiên cứu này. Một cách giải thích hợp lý về việc thiếu sự chọn lọc ở mức tế bào gốc là do có sự biểu hiện MDR nội sinh ở mức tương đối cao trong nhiều tế bào tạo máu nguyên thủy. Khi đưa vào tế bào các MDR thể đột biến kháng các chất ức chế của P-glycoprotein hoang dã có thể chọn lọc được các tế bào gốc tải nạp tốt hơn là các tế bào chỉ biểu hiện nội sinh MDR dạng hoang dã.
Việc sử dụng gen DHFR cho việc chọn lọc in vivo đã được dự đoán trước từ nhiều năm rồi, nhưng cách tiếp cận này không mang lại thành quả, vấn đề này chỉ được giải quyết cho đến tận khi Allay và cộng sự chứng minh được rằng với các antifolat (trong trường hợp này là trimetrexat) thì bản thân nó không gây được hiệu ứng với tư cách là trung gian gây độc tế bào gốc mà độc tính tế bào gốc chỉ có khi đươc phân phối đồng thời với NBMRP - P để ngăn ngừa sự cứu hộ của nucleosid và cứu được độc tính của antifolat. Allay và cộng tác sau đó lại tiếp tục khẳng định khả năng sử dụng cách tiếp cận dược lý học trong việc mở rộng các tế bào tải nạp L22Y của người theo cách là làm ổn định lâu dài các đối tượng nhận sơ cấp cũng như các đối tượng nhận cấy ghép thứ cấp. Các nhà khoa học đã khẳng định tính chọn lọc của các tế bào gốc biểu hiện DHFR cũng tương tự như các điều kiện dược lý học như đã được Allay và cộng tác mô tả. Tuy nhiên, những điều kiện tin cậy trong chọn lọc in vivo các tế bào gốc biểu hiện DHFR ngay từ khi khởi đầu cấy ghép (từ 0,1 đến 1%) thì vẫn chưa được thiết lập.
Hệ AGT nổi bật là một hệ thành công nhất đạt được trong chọn lọc in vivo. AGT kháng thuốc được chứng minh là cho phép làm giầu tới 940 lần các thành viên tế bào tổ tiên của tủy tải nạp G156A được cấy ghép vào chuột nonmyeloblat sau khi được xử lý với BG và BCNU – một mức chọn lọc in vivo lớn hơn mức đã quan sát thấy với các gen kháng thuốc khác. Ragg và cộng tác, Sawai và cộng tác đã báo cáo, dựa trên việc cấu trúc lại tế bào tạo máu của các đối tượng ghép thứ cấp nối tiếp thì sự chọn lọc in vivo ở mức tế bào gốc tạo máu có được là do việc xử lý thuốc trên chuột được ghép tủy tải nạp P140K. Việc phân phối thuốc trong những nghiên cứu này gồm BG và BCNU mỗi tuần 1 lần, kéo dài 4-5 tuần hoặc BG và temozolomid 5 lần một tuần, kéo dài 3-4 tuần.
Trái ngược với hệ AGT, sự chọn lọc tế bào gốc trong hệ DHFR đòi hỏi phải phân phối hàng ngày trimetrexat + NBMPR - P trên 2 tuần với vài chu kỳ xử lý qua một thời gian dài. Sự khác nhau giữa 2 hệ thống này là ở chỗ các cơ chế tác động của chúng rất khác nhau. Đối với antifolat, sự chọn lọc được dựa trên hiệu ứng kháng tăng sinh thu được từ các nhóm thâm thụt nucleotid purin và thymidin, đòi hỏi phải có sự hiện diện tiếp tục của thuốc trong quá trình chọn lọc. Đối với các chất alkyl hóa như BCNU, những kết quả thu được đơn giản là do cải biến DNA làm cho sự tăng sinh tiếp theo sẽ không có thuốc và dẫn đến việc phát ra một tín hiệu apoptosis và tế bào bị chết, trừ khi sự hư hỏng này được sửa chữa bởi AGT.
NGHIÊN CỨU THỬ NGHIỆM TRÊN ĐỘNG VẬT LỚN VÀ NGƯỜI
Các nghiên cứu về biểu hiện và chuyển gen kháng thuốc ở động vật lớn cho tới nay vẫn còn hạn chế, nhưng dầu sao những vấn đề về sự thách đố tế bào, di truyền học và dược lý học của chuyển gen cũng đã được nghiên cứu rộng rãi. Stead và cộng sự đã báo cáo các nghiên cứu về chuyển gen DHFR bởi retrovirus ex vivo trên chó, qua đó cho thấy nó bị hạn chế do hiệu lực chuyển gen kém. Trong nghiên cứu về chuyển gen MDR ở khỉ đuôi sóc (marmoset), Hibino và cộng sự báo cáo đã phát hiện thấy các tế bào tạo máu tải nạp sau cấy ghép 400 ngày, nhưng lại có một ít (dưới 1%) các tế bào bạch cầu hạt máu ngoại vi tải nạp không bảo vệ được động vật kháng lại sự giảm bạch cầu do cảm ứng docetaxel. Việc cấy ghép dài hạn cũng quan sát thấy ở khỉ rhesus được truyền tủy tải nạp MDR. Có các tế bào tải nạp đạt mức khởi đầu cao sau đó lại rơi xuống mức thấp mặc dù đã được bổ sung cytokin. Một báo cáo ex vivo về chuyển gen MDR trên chó đã ghi nhận có các tế bào máu ngoại biên tải nạp sau khi được xử lý với taxol nhưng sau khi ngừng thuốc thì mức tế bào lại giảm xuống, tuy nhiên cũng duy trì được tới 16 tháng.
Những kết quả này cho thấy, mặc dầu đã tải nạp thành công các tế bào gốc tạo máu nguyên thủy, nhưng sự chọn lọc cao hơn chỉ xảy ra chủ yếu ở các quần thể tế bào đã biệt hóa. Có một ngoại lệ quan sát thấy trong các động vật lớn ở hệ AGT là có hiện tượng tăng ổn định các tế bào dương tính AGT sau khi được phân phối BCNU + BG. Những kết quả này đã tạo hy vọng cho việc áp dụng sự biểu hiện và chuyển gen kháng thuốc như một phương thức chọn lọc in vivo làm tăng trình diện của các tế bào tải nạp gen in vivo.
Sự thành công của các nghiên cứu về sự chuyển gen MDR trên động vật là các tiền đề tiền lâm sàng cho việc thực hiện các thử nghiệm chuyển gen trên người (Bảng 14.1). Những thử nghiệm này đã được thiết kế để test trước tiên về hiệu lực tải nạp retrovirus làm trung gian đưa các gen chuyển vào trong các quần thể tế bào tạo máu, sau đó xác định xem việc xử lý như vậy có bảo vệ được các bệnh nhân khỏi sự ức chế tủy hay không để có những giải pháp thích hợp.
Hanania và cộng sự báo cáo có tải nạp cao trong các đơn vị hình thành quần thể bạch cầu hạt - đại thực bào (CFU-GM). Cowan và cộng tác báo cáo có các mức tương đối cao (9%) bạch cầu hạt mang dấu ấn MDR vẫn tồn tại khi sử dụng nhiều lần paclitaxel trong một bệnh nhân được ghép tủy tải nạp MDR, tuy nhiên những mứcònày cuối cùng cũng bị hạ thấp dần.
Bảng 14.1. Các quy trình bảo vệ hóa học lâm sàng đối với người
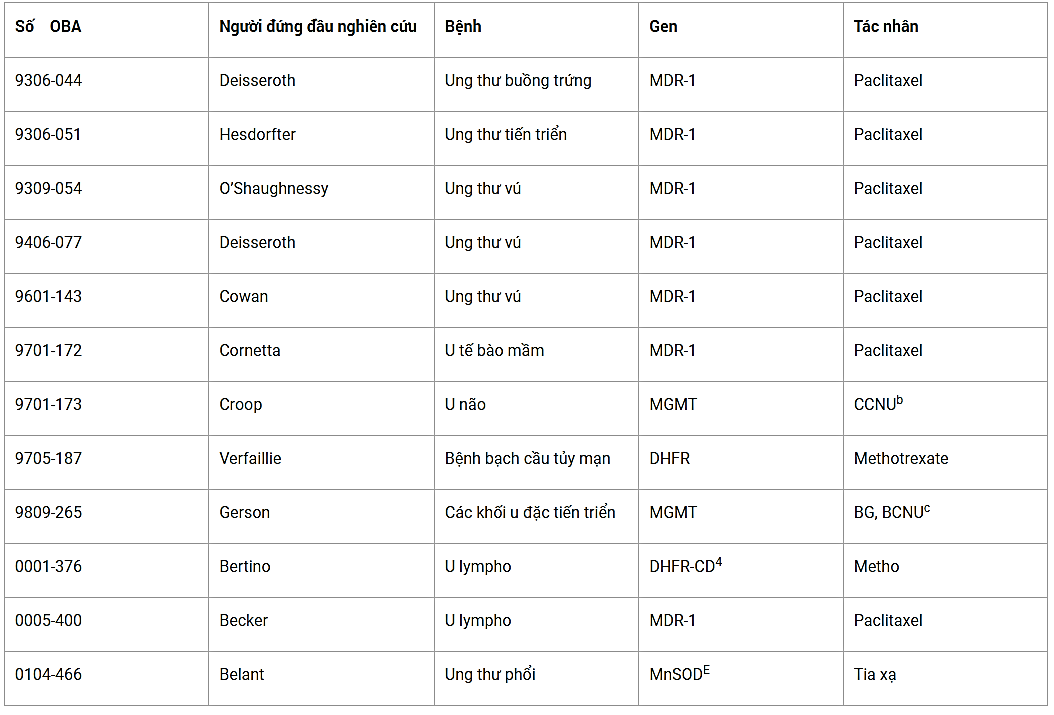
Ghi chú:
a = Được liệt kê bởi Office of Biotechnology Activities 2003.
b = bCCNU , lomustine.
c = cBG, BCNU.
d = dCD, cystidine deaminase.
e = eMnSOD, manganese superoxite dismutase.
Một số nghiên cứu cũng phát hiện thấy dấu ấn tế bào ở mức thấp thậm chí không thể phát hiện được ở các bệnh nhân khi áp dụng quy trình cải tiến tải nạp retrovirus. Abonour và cộng sự đã đạt được sự chuyển gen MDR ở mức cao hơn trong các tế bào tạo máu và báo cáo có tăng nhẹ sự trình diện tế bào tải nạp khi được xử lý với Taxol. Công trình này được xem như đã cung cấp các chứng cứ về tính khả thi của sự chuyển gen vào trong các tế bào tạo máu và mở rộng thêm khái niệm về chọn lọc in vivo với người.
Trong tất cả các hệ kháng thuốc đã đề cập trong chương này thì MDR có lợi thế nhất cho các ứng dụng lâm sàng. Tuy nhiên, ngay cả với MDR thì mục đích chính của thao tác gen (cho phép hóa trị “hiếu chiến” hơn hoặc làm giảm độc tính ở liều không tăng dần) cũng vẫn chưa được giải quyết trong lâm sàng.
KẾT LUẬN VÀ CÁC NGHIÊN CỨU TRONG TƯƠNG LAI
Các tế bào tạo máu đã có một thời gian dài được coi là quần thể đích chủ chốt cho sự chuyển gen liệu pháp và việc đưa vào các gen kháng thuốc là chiến lược chủ chốt, theo đó việc chuyển gen vào các tế bào tạo máu có thể được áp dụng trong điều trị ung thư. Những tiến bộ đạt được trong lĩnh vực này như đã tóm tắt ở trên đã chứng minh được tiềm năng của các chiến lược trong các hệ thống mô hình tiền lâm sàng cũng như các thử nghiệm lâm sàng khởi đầu. Khả năng làm cho động vật ít nhạy cảm với độc tính của thuốc rõ ràng là cần phải có sự kết hợp giữa các tác nhân hóa trị và các gen kháng thuốc. Mức độ tăng dần liều có thể áp dụng để nâng cao khả năng trị liệu kháng u phụ thuộc vào sự tăng thực tế của liều dung nạp đạt được thông qua sự biểu hiện gen kháng thuốc. Khả năng áp dụng tăng liều dung nạp có thể được thực nghiệm trực tiếp trên các động vật mang u để nâng cao hiệu ứng kháng u ở liều dung nạp cao hơn qua sự biểu hiện gen kháng thuốc.
Các gen kháng thuốc cũng có thể được áp dụng trong chọn lọc in vivo, trong việc mở rộng quần thể các tế bào biểu hiện gen kháng thuốc nhờ sự điều khiển của các tác nhân chọn lọc. Khả năng áp dụng phương pháp này sẽ còn phụ thuộc vào mức độ mở rộng của các tế bào biểu hiện gen kháng thuốc có thể đạt được. Tính chọn lọc như vậy sẽ càng mở rộng khả năng sử dụng sự chuyển gen kháng thuốc trong điều trị các bệnh di truyền và các bệnh khác ngoài ung thư.
TÀI LIỆU THAM KHẢO CHÍNH
BeRNArd R. Glick, Jack J. PasteRNArk (2007), Công nghệ Sinh học phân tử (Tài liệu dịch), Nhà xuất bản Khoa học Kỹ thuật.
Trần Thúy Hạnh (2007), Một số khía cạnh về Dị ứng Miễn dịch lâm sàng hiện đại, Nhà xuất bản Y học.
Nguyễn Văn Kình (2005), Gen trị liệu. Nhà xuất bản Y học.
Nguyễn Văn Kình, Nguyễn Quốc Tuấn, Nguyễn Tuấn Anh (2007), Thực hành ứng dụng Gen trị liệu, Nhà xuất bản Y học.
Phan Kim Ngọc, Phạm Văn Phúc, Trương Định (2010), Công nghệ Tế bào gốc, Nhà xuất bản Giáo dục.
Aland T. Barrett and Lawrence R. (2009), Vaccin, Copyright© Elsevier Inc.
Alexander Batter (2006), Stem Cell and Gene-Based Therapy, Frontier in Regenertive Medicine. Springer-Verlage London Limited.
Andreas Offenhaüsser (2008), Nanobioelectronics for Electronics, Biology and medicine. Springer.
Chi Wai. Eric So (Eds) (2008), Leukemia (Methods and Protocols). Humana Press.
E.Nigel Wardle (2008), Guide to Signal Pathways in Immune Cells. Humana Press.
Erwin G. Van Meir (2009), CNS Cancer, Human Press.
Greoffrey S. Ginsburg, Huntingtonn F. Willard (2010), Esstials of Genomic and Personalized Medicine. Amsterdam. Boston. Heidenberg. London. Newyork. Oxford. Paris. San diego . San Francisco. Sydney. Tokyo.
Jaque Zimmer (2010), Natural Killer Cells. Springer-Verlage Berlin Heidelberg.
John D. Potter. Noralane M. Lindor (2008), Genetics of Colorectal Cancer. Springer.
Joseph Panno (2005), The Cell. Copyright© by Joseph Panno.
Karvita B. Ahluwalia (2009), Genetics second Edition. New Age intweRNAtional Limited, Publishers.
Kathleen Sakamoto. Eric Rubin (2009), Modulation of Protein Stability in cancer Therapy, Springer Science Business media.
M.A. Hayat (2008), Liver Cancer, Springer.
Michael R. Shurin. Russel D. Salter (2008), Dendritic Cell in Cancer. Springer.
Michelle Raabe (2008), Genes & Disease Hemophilia, Copyright © by Infobase Publishing.
M.Molls, P. Vaupel, C. Nieder, M.S. Anscher (Eds) (2009), The impact of Tumor Biology on Cabcer treatment and Multidisciplinary Strategies. Springer-Verlag Berlin Heidelberg.
Peter J. Quesenberry, Gary S. Stein, BeRNArd G. Forget, Sherman M. Weissman (2005), Stem Cell Biology and Gene Therapy. Willey-Liss.
Ralf Kühn, Wolfgang Wurst (2009), gene Knockout Protocols. Humana Press.
Rebecca G. Bagley, Beverly A.. Teicher (2009), Stem Cells and Cancer, Human Press.
Robert Lanza (Eds) (2010), Essentials of Stem Cell Biology. John Georhort. Brigid Hogon. Douglas. Roger Pederse. E. Donanal Thomas. Jam Thomson.
Robert Stern (Eds) (2009), Hyaluronan in cancer Biology. Academic Press is an imprint of Elsevier.
T.Tachikawa, K. Nose, T. Ohmori, M. Adachi (Eds) (2009), New trends in the Molecular and Biological. Basics for Clinical Oncology. Springer.
Thomas C, G. Bosch (2008), Stem Cells: From Hydra to man. Springer.
Uma Lakshmipathy, Jonathan D. Chesnut, Braska Thyagarajan (2009), Emerging Technology platforms for Stem Cells. A John Wiley & Son, inc., Publication.
Vemu (2006), Stem Cell Assays, Human Press, Totowa, NJ.
Vijay K. Varadan, Linfeng Chen, Jining Xie (2008), Nanomedicine. Wiley.
Vinagulu K. Rajasekhas, Mohan C. Vemuri (Eds) (2009), Regulatory Network in Stem Cell, Human Press.
Wiestler, B. Haendler, D. Mumberg (2007), Cancer Stem Cells: Novel Concepts and Prospects for Tumor Therapy, Springer.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh






