️ Thay thế các gen kiềm chế khối u trong ung thư (P2)
Các nghiên cứu tiền lâm sàng về thay thế gen p53
Các nghiên cứu trong phòng thí nghiệm trước đây ở mô hình ung thư phổi của người đã chứng minh rằng TSG p53 được chuyển giao qua vec tơ biểu hiện retrovirus đã hoàn trả sự kiềm chế tăng trưởng khối u. Tương tự như vậy, sự hoàn trả p53 chức năng đã kiềm chế tăng sinh của một số chứ không phải toàn bộ các dòng TB ung thư phổi trên người. Mặc dầu việc chuyển gen TB khối u kiềm chế tăng trưởng đã được chứng minh là thành công với các vec tơ biểu hiện retrovirus, nhưng hiệu ứng tải nạp của vec tơ này vẫn bị giới hạn như vốn có của nó. Khác với retrovirus, các adenovirus lại có thể được sản xuất ở các độ chuẩn cao và có khả năng thâm nhiễm cả TB đang phân chia cũng như không phân chia. Do vậy, những thí nghiệm tiếp sau đó đã được thực hiện với các vec tơ adenovirus.
Vì adenovirus không hợp nhất vào trong hệ gen nên biểu hiện của nó ngắn. Tuy nhiên, tình trạng này không được coi là bất lợi trong GTL ung thư vì sự phá hủy các TB ung thư mới là điểm mong muốn cuối cùng của trị liệu.
Lúc đầu người ta sợ rằng hiệu ứng GTL đối với ung thư có thể bị giới hạn vì khó có khả năng một vec tơ lại có thể tải nạp được mọi TB trong một khối u. Tuy nhiên, Fujiwara, Cusack và các đồng nghiệp đã chứng minh rằng trong cấu trúc 3 chiều chất kết dính (matrix) TB ung thư và ghép ngoại lai dưới da thì gen dùng để trị liệu dường như là được phát tán xa dần từ vị trí tiêm (trực tiếp tức thời vào khối u) tới các TB khối u không tải nạp thông qua hiệu ứng người ngoài cuộc (bystander). Việc giết chết người ngoài cuộc dường như có liên quan tới các cơ chế phức tạp hơn chứ không đơn thuần là sự trải rộng của các vec tơ ra ngoài vị trí tiêm. Một vài cơ chế giả định là sự tạo mạch (angiogenesis), điều hòa tăng miễn dịch và tiết các protein tiền apoptosis hòa tan.
Việc chuyển p53 vào các TB ung thư đã được Zhang và cộng sự chứng minh cũng như trong các nghiên cứu kế tiếp, phức hợp gen /vec tơ (Adp53) này đã cảm ứng apoptosis các TB ung thư (p53 đã mất chức năng) nhưng không tác động đáng kể tới tăng sinh của các TB bình thường.
Adp53 cũng ức chế tăng sinh khối u với mô hình ung thư phổi của người trên chuột và cảm ứng apoptosis cũng như kiềm chế sự tăng sinh các dòng TB gây ung thư tụy, ung thư trực - kết tràng và các khối u trên vú của người. Các nghiên cứu in vivo về chuyển gen p53 trong mô hình ghép ngoại sinh khối u trên chuột cũng cho thấy có kiềm chế đáng kể tăng sinh các khối u trên người. Các TSG khác cũng kiềm chế tăng sinh khối u trong nuôi cấy TB và trong các mô hình trên động vật.
Các thử nghiệm lâm sàng về thay thế gen p53
Từ những kết quả nghiên cứu tiền lâm sàng về p53 retrovirus đã dẫn tới việc phê chuẩn một protocol thử nghiệm lâm sàng đầu tiên về thay thế gen p53. Một vec tơ retrovirus biểu hiện p53 hoang dã dưới sự kiểm soát của promoter - actin đã được đưa vào các khối u của 9 bệnh nhân ung thư phổi không tế bào nhỏ mà không thể phẫu thuật được (non small cell lung cancer NSCLC) và đã kháng lại các phương pháp điều trị khác. Người ta không thấy độc tính liên quan tới vec tơ và 3 trong số 9 bệnh nhân đã có bằng chứng là có hoạt tính kháng u. Điều đó đã chứng minh cho tính khả thi và độ an toàn của gen trị liệu. Vì những lý do đã nêu trên nên những thử nghiệm lâm sàng xa hơn về sự chuyển gen p53 người ta đã sử dụng vec tơ biểu hiện adenovirus.
Có 18 bệnh nhân NSCLC không đáp ứng với các phương pháp điều trị thông thường đã được tuyển mộ vào thử nghiệm lâm sàng pha I. 80% bệnh nhân được đánh giá là đã chuyển gen thành công. DNA p53 đặc hiệu vec tơ phát hiện thấy ở 46% bệnh nhân, apoptosis thấy ở tất cả các bệnh nhân, một trong số các bệnh nhân biểu hiện được gen này. Điều quan trọng nhất là mặc dù mỗi bệnh nhân phải tiêm tới 6 mũi nhưng không thấy xuất hiện hiệu ứng gây độc đáng kể liên quan tới sự chuyển vec tơ. Thêm vào đó là có 2 bệnh nhân giảm kích thước khối u tới 50%. Một bệnh nhân duy trì tình trạng không khối u trên 1 năm sau khi kết thúc trị liệu và trên thực nghiệm với khối u nội phế quản đã kháng lại hóa trị, xạ trị và laser đã cho kết quả tuyệt với - các khối u dường như thoái lui hoàn toàn.
Một công trình nghiên cứu pha I trên 33 bệnh nhân bị ung thư vùng đầu, cổ tế bào vảy cũng cho kết quả là việc chuyển cấu trúc p53 tuy có gây độc tính nhẹ, nhưng lại có đáp ứng lâm sàng rõ ràng ở 9 trong số 18 bệnh nhân khảo sát. Thử nghiệm lâm sàng pha II tiếp theo với p53 cho trên 200 bệnh nhân bị ung thư vùng đầu, cổ tế bào vảy tái phát cũng cho kết quả: đáp ứng toàn phần hoặc từng phần với khoảng 10% bệnh nhân. Có một số bằng chứng cho thấy có hoạt tính kháng u ở 60% bệnh nhân.
Những nghiên cứu này cùng các công trình khác nữa đã chứng tỏ được rằng chuyển gen p53 là một chiến lược lâm sàng khả thi, kết quả là chuyển gen và biểu hiện gen thành công, độc tính thấp và được chỉ định chắc chắn cho việc làm thoái lui các khối u. Thử nghiệm lâm sàng về sự thay thế PSG đã được đăng ký bao gồm các thử nghiệm liên quan tới p53, Rb, mda7, BRCA1 và p16 đã được tóm tắt trong Bảng 3.2. Lưu ý rằng, tất cả các thử nghiệm lâm sàng liên quan tới DNA tái tổ hợp được thực hiện ở các Viện nghiên cứu muốn nhận được quỹ của liên bang phải được Viện sức khỏe quốc gia (NIH), Hội đồng cố vấn DNA tái tổ hợp (RAC) phê chuẩn. Với các nghiên cứu không nhận được quỹ liên bang cũng phải trình protocol và các hiệu ứng phụ khi điều trị để tổng hợp vào kho số liệu của NIH.
Bảng 3.2. Các thử nghiệm lâm sàng về sự thay thế TSG
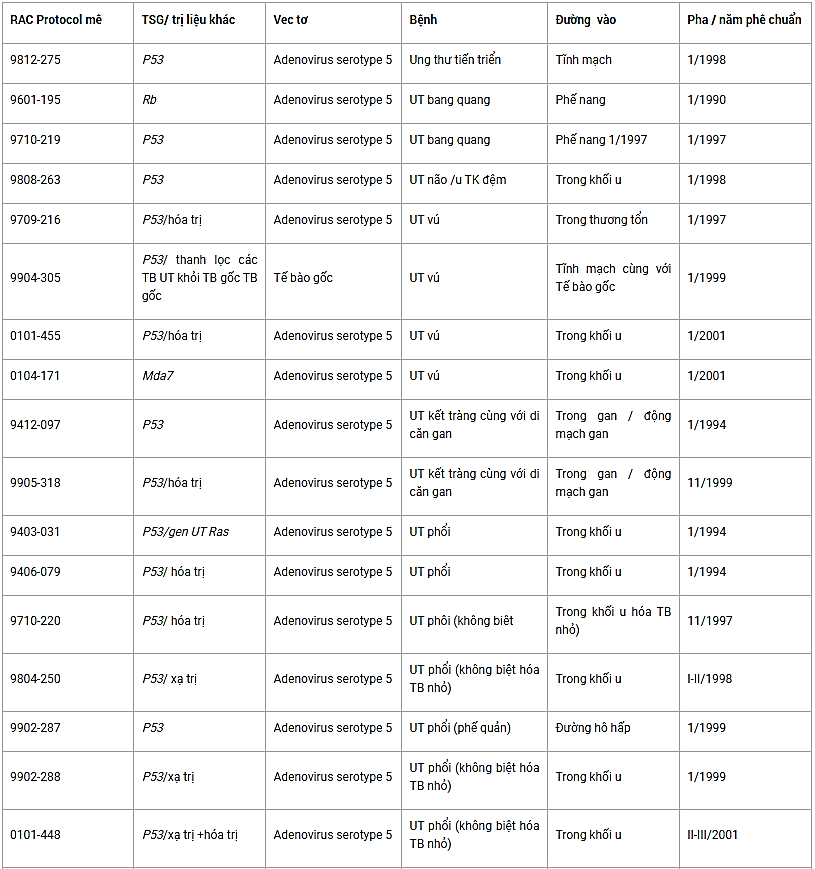
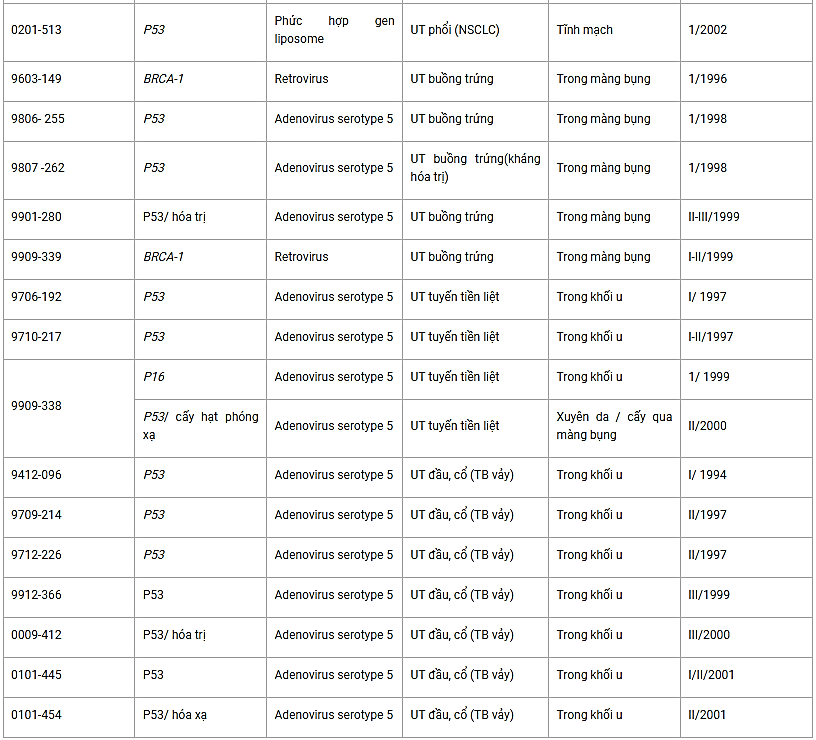
Thay thế gen p53 kết hợp với các tác nhân gây hủy hoại DNA thông thường
Lý do cơ bản của trị liệu kết hợp
Nhiều bệnh nhân thất bại với các phương pháp thông thường bởi vì các khối u của họ đã kháng lại các tác nhân hủy hoại DNA như hóa trị, xạ trị. Một lần nữa ẩn ý là apoptosis như là một cơ chế bình thường của phá hủy tế bào trong đáp ứng với các tác nhân hủy hoại DNA, theo sau đó là khiếm khuyết trên con đường apoptosis bình thường có thể lại ban cho các tế bào ung thư một sức đề kháng lạ thường. Thường để làm mất chức năng các khối u đã kháng lại hóa trị và xạ trị thì p53 giữ vai trò rất quan trọng trong việc phát hiện sự hủy hoại DNA và định hướng cho sửa chữa hay phá hủy TB thông qua apoptosis. Sự liên hệ giữa p53 và apoptosis đã tạo dựng nên các chiến lược trị liệu kết hợp thay thế gen p53 và các phương pháp trị liệu hủy hoại DNA thông thường. Độc tính thấp (ít hơn 5% sự cố nghiêm trọng) của p53 trong các thử nghiệm khởi đầu đã chứng minh rằng gen trị liệu với p53 có thể được kết hợp cùng với các phương pháp trị liệu kháng ung thư khác mà không làm tăng độc tính trong quá trình trị liệu.
Các nghiên cứu tiền lâm sàng
Một vài nghiên cứu in vitro đã chứng minh rằng việc biểu hiện quá mức p53 trong các dòng TB thâm chuyển p53 dạng hoang dại có thể dẫn các TB tới apoptosis. Theo sau in vitro và các nghiên cứu trên động vật là kiểm tra apoptosis ở các TB ung thư đã được xử lý với các tác nhân xạ trị và hóa trị càng củng cố cho ý kiến cho rằng có sự liên kết giữa cảm ứng apoptosis và biểu hiện p53 chức năng.
Các nghiên cứu tiền lâm sàng và gen trị liệu p53 kết hợp cùng cisplatin trong nuôi cấy tế bào NSCLC và ghép ngoại lai người trên chuột nude đã chứng minh rằng khi thực hiện nối tiếp việc đưa cisplatin vào và gen trị liệu p53 sẽ làm tăng biểu hiện các sản phẩm gen p53. Trên 50% tế bào xử lý trước với cisplatin đã có apoptosis sau chuyển gen 12 giờ; trên 90% tế bào trải qua apoptosis sau 24 giờ. Những TB không được tiền xử lý với cisplatin trước khi chuyển gen thì chỉ có 19 và 68% tế bào apoptosis ở 12 giờ và 24 giờ. Các nghiên cứu trị liệu với cisplatin toàn hệ thống trước khi chuyển gen p53 vào chuột nude đã cho kết quả làm giảm ít nhất 50% kích thước khối u khi so sánh với chuột chỉ được chuyển gen p53 đơn thuần.
Tương tự như vậy, các nghiên cứu tiền lâm sàng về chuyển gen có sự kết hợp với xạ trị cho thấy chuyển gen p53 tới các TB khối u khiếm khuyết p53 thì cả in vitro và in vivo đều tăng độ nhạy cảm với xạ trị. Khi các TB ung thư trực kết tràng người nuôi cấy in vitro được chiếu tia gamma thì 55% các TB khối u vẫn còn sống sót; khi thâm chuyển các TB với p53 trước khi tia xạ thì hạ thấp tỷ lệ sống sót các TB ung thư tới 23% và tăng apoptosis. Sự kiềm chế khối u đáng kể cũng quan sát thấy ở mô hình khối u trên động vật khi chúng nhận p53, sau đó là xạ trị; tái tăng trưởng các khối u cũng chậm đi 2 ngày khi khối u chỉ được xử lý bằng xạ trị và 15 ngày khi xử lý bằng chuyển gen. Tuy nhiên, các khối u của động vật khi nhận gen p53 rồi sau đó xạ trị thì đòi hỏi phải mất 37 ngày mới đạt được kích cỡ ở thời điểm trước khi điều trị.
Rất nhiều công trình nghiên cứu khác đã được thực hiện càng ủng hộ ý kiến cho rằng có bằng chứng về sự liên hệ đặc biệt giữa độ nhạy cảm xạ trị và khả năng cảm ứng apoptosis của một tế bào. Tuy nhiên, độ nhạy cảm phóng xạ của một vài dạng u (chẳng hạn như u biểu mô) thì không thấy có sự liên quan tới trạng thái của p53.
Các thử nghiệm lâm sàng về thay thế TSG kết hợp với hóa trị liệu
Thử nghiệm p53 pha I phối hợp với cisplatin được tiến hành trên 24 bệnh nhân ung thư NSCLC trước đó đã không đáp ứng với các phương pháp điều trị thông thường. Về phần bệnh nhân, 75% tham gia thử nghiệm đã được chứng minh từ trước là khối u có tiến triển trong chế độ điều trị với cisplatin hay carboplatin. Sau liệu trình điều trị 6 tháng đưa cisplatin qua đường tĩnh mạch và cứ 3 ngày lại tiêm p53 vào khối u, kết quả là 17 bệnh nhân duy trì ổn định ít nhất 2 tháng, 2 bệnh nhân có đáp ứng phần nào và 4 bệnh nhân vẫn tiếp tục ức chế được bệnh (một bệnh nhân không được đánh giá về tiến triển của bệnh). Phân tích hoạt tính apoptosis ở sinh thiết u cho kết quả 79% tăng số TB apoptosis, 14% không thay đổi và 7% giảm apoptosis.
Một nghiên cứu pha II nhằm đánh giá so sánh 2 tổn thương trên mỗi bệnh nhân có NSCLC di căn. Tất cả bệnh nhân được hóa trị hoặc 3 chu kỳ với carboplatin cộng với pacitaxel hoặc 3 chu kỳ cisplatin cộng với vinorelbin. P53 được tiêm trực tiếp vào trong một tổn thương, còn tổn thương kia được dùng làm đối chứng và không được tiêm thuốc. Mục tiêu của nghiên cứu này là chứng minh có tăng đáp ứng phóng xạ trong tổn thương được tiêm để so sánh với tổn thương không được tiêm. Việc trị liệu bằng p53 cho kết quả là độc tính liên quan tới vec tơ là nhỏ nhất và không tăng thêm các sự kiện đối nghịch liên quan tới hóa trị. Phân tích thống kê các số liệu đã hợp nhất cho thấy p53 không làm tăng lợi ích cho các bệnh nhân được hóa trị lần đầu. Kết quả kiểm tra cho thấy nếu chỉ sử dụng cisplatin hay vinorelbin đơn lẻ thì thành công rất thấp. Tuy nhiên, cũng nhận thấy rằng sự thoái lui của khối u cục bộ khi đo kích thước thì thấy các tổn thương được tiêm p53 tốt hơn tổn thương đối chứng.
Một nghiên cứu lâm sàng pha I/II do Buller và cộng sự thực hiện trên các bệnh nhân ung thư buồng trứng tái phát đã chứng được độ an toàn và tính dung nạp đối với p53 liều đơn hay đa liều được đưa qua màng bụng kết hợp cùng hóa trị liệu với nền tảng platin. Một nghiên cứu dài hạn về các bệnh nhân này cho thấy: những cá thể nhận đa liều p53 cùng với hóa trị thì thời gian sống sót trong khoảng 12-13 tháng, còn các bệnh nhân được xử lý với liều đơn p53 thì thời gian sống sót chỉ khoảng 5 tháng. Sau hơn 20 tháng trị liệu với đa liều cho các bệnh tái phát đã có 10 người sống sót dài hạn, trong khi đó chỉ có 2 bệnh nhân nhận liều đơn p53 là sống sót dài hạn.
Các thử nghiệm lâm sàng về thay thế TSG kết hợp với xạ trị
Sự thành công trong các nghiên cứu tiền lâm sàng cho thấy việc thay thế gen p53 có thể tạo tính nhạy cảm phóng xạ đối với một số u, do đó dẫn tới việc khởi đầu thử nghiệm lâm sàng pha II về chuyển gen p53 qua trung gian adenovirus đi cùng với xạ trị. Những số liệu sơ bộ có được từ 19 bệnh nhân ung thư NSCLC đã cho thấy có đáp ứng đầy đủ ở 1 bệnh nhân (5%), đáp ứng từng phần ở 11 bệnh nhân (58%), bệnh ổn định ở 3 bệnh nhân (16%) và bệnh tiến triển ở 2 bệnh nhân (11%). Có 2 bệnh nhân (11%) không được đánh giá vì u tiến triển hoặc chết sớm. Sau 3 tháng hoàn tất trị liệu, các kết quả sinh thiết cho thấy khối u không còn tồn tại ở 12 bệnh nhân (63%) và khối u vẫn còn tồn tại ở 3 bệnh nhân (16%). Khối u của 4 bệnh nhân (21%) không được sinh thiết vì khối u tiến triển hoặc chết sớm hoặc bệnh nhân quá yếu. Tỷ lệ sống sót sau 1 năm u không tiến triển là 45,5%. Trong số 13 bệnh nhân được khảo sát thì 5 bệnh nhân (38%) có đáp ứng đầy đủ và 3 bệnh nhân (23%) đáp ứng từng phần hoặc bệnh ổn định. Hầu hết các trường hợp không thành công đều là do bệnh đã di căn, không còn tính chất cục bộ nữa.
PHƯƠNG HƯỚNG TƯƠNG LAI
Mặc dầu những thử nghiệm sớm này về thay thế TSG đã chứng minh rõ ràng gốc rễ của nguyên lý, nhưng việc trị liệu với TSG hiện nay vẫn chưa được áp dụng một cách rộng rãi. Các TSG hiện tại chỉ mới được chuyển tới các khối u bằng kim tiêm hay nọi soi. Do vậy việc cải tiến hệ thống chuyển gen là trọng yếu cho sự phát triển tương lai. Hơn nữa, các chiến lược nhằm tận dụng hiệu ứng người ngoài cuộc cũng đang được triển khai và sự kết hợp giữa trị liệu TSG cùng với chuyển gen nhằm ngăn chặn tạo mạch hoặc tăng cường khả năng hệ miễn dịch cũng là một chân trời mở rộng. Những khám phá tiếp tục về thay thế TSG với tư cách là một công cụ hỗ trợ cho các phương pháp thông thường như hóa trị, xạ trị và phẫu thuật vẫn được nhìn nhận một cách tích cực.
Hiệu ứng người ngoài cuộc
“Giết chết người ngoài cuộc các TB khối u chưa được tải nạp được coi như là một yếu tố quan trọng cho thành công của trị liệu thay thế, vì vậy cho đến nay các chiến lược nhằm tăng cường hiệu ứng này đang được nghiên cứu. Các cơ chế đã được chứng minh về giết người ngoài cuộc bao gồm: ức chế sự tạo mạch, điều hòa lên các thành phần của hệ miễn dịch và tiết các protein tiền apoptosis hòa tan.
Phát triển các vec tơ
Các phương pháp điều trị bằng gen đã được sử dụng cho đến nay trong các nghiên cứu lâm sàng với việc sử dụng các vec tơ là retrovirus, adenovirus và herpes để chuyển các gen vào trong khối u đang rất hứa hẹn. Nhưng vấn đề lớn trong ung thư là việc điều trị các bệnh đã lan tỏa rộng thuộc phổi, vú, trực tràng thì lại đòi hỏi sự phân phối gen toàn hệ thống. Các vec tơ virus bộc lộ được các vấn đề lý thuyết cũng như thực tế vì nó cảm ứng được các đáp ứng miễn dịch và các vấn đề liên quan tới độc tính. Những nghiên cứu sơ bộ cho thấy các liposom được bắn ra có đủ hiệu lực để chuyển các gen một cách hệ thống tới các vị trí xa, với độc tính vec tơ có thể chấp nhận được. Trong các nghiên cứu xa hơn về các liposome này thì 2 TSG (p53 và Fhit) đã được chuyển tới các TB khối u in vitro, trong mô hình trên chuột cũng như trong các khối u lan tỏa của người. Biểu hiện gen chuyển trong mỗi khối u quan sát thấy là 25% số tế bào. Biểu hiện có ý nghĩa đáng kể cũng thấy cả trong ung thư phổi nguyên phát cũng như đã di căn. Lập lại các liệu trình trị liệu cũng cho kết quả là tăng 2, 5 lần biểu hiện gen, tăng hiệu quả trị liệu (khi so sánh với những cách điều trị đơn lẻ). Công trình nghiên cứu này đã chứng minh rằng việc chuyển giao qua trung gian liposom của ít nhất 2 TSG có thể kiềm chế được sự tăng trưởng khối u in vivo khi được phân phối theo cả hệ thống hay theo từng khu vực; không thấy các hiệu ứng gây độc liên quan tới cách trị liệu này và hệ thống chuyển gen này không bị giới hạn bởi gen hay dạng khối u. Hơn nữa, đã có những kết quả chứng minh về tiềm năng của đa trị liệu mà không gây hiện tượng đề kháng.
Mô đích
Một cách tiếp cận khác nhằm nới rộng ứng dụng GTL mà không cần sử dụng kim tiêm hay nội soi là sử dụng vec tơ adenovirus tái tổ hợp nhằm vào các dạng đặc biệt của TB bằng thao tác các thành phần gắn trên bề mặt TB của hạt virus. Các protein nối 2 chức năng này được cấu trúc bởi một đoạn kháng thể đặc hiệu với protein sợi virus và ligand, yếu tố tăng trưởng biểu bì. Khi cho thêm vào protein này một adenovirus đã làm tăng hiệu quả tải nạp của dòng TB ung thư biểu bì gấp 16 lần so với thâm nhiễm với vec tơ adenovirus tự nhiên.
Một cách tiếp cận khác để chuyển trực tiếp các gen đích tới các TB nội mô có liên quan tới một phân tử bề mặt TB là integrin v3 - có tiềm năng tiếp thu các adenovirus. Hạt nano cation gắn vào integrin targeting ligand có khả năng chuyển các gen một cách chọn lọc tới các mạch máu chuột đang mang khối u.
Thay thế TSG kết hợp với các chiến lược gen trị liệu khác
Các TSG bổ trợ được chuyển giao có thể hợp tác với nhau để cảm ứng apoptosis hiệu quả hơn. Nhồi các TSGp16INK4 và p53 trong một tổ hợp sẽ cho một hiệu ứng cộng lực cảm ứng apoptosis các TB gan ung thư (đột biến p53) và các TB ung thư trực tràng (p53 biểu hiện rất thấp) in vitro. Việc chuyển giao TSG trong tổ hợp cùng với các gen ung thư khác cũng đang được khảo sát.
Nhận dạng các TSG mới
Các phương pháp sàng lọc những phân đoạn lớn của hệ gen cho các TSG ứng cử viên đã phát hiện được rất nhiều gen hữu ích như các chỉ thị cho sự tiên lượng hoặc chẩn đoán sớm trong việc theo dõi những nỗ lực phòng ngừa cũng như phát triển các chiến lược trị liệu mới. Nhiều gen kế cận nhau có thể gây ức chế hoạt tính kiềm chế khối u in vitro và in vivo đã được nhận dạng và nó cho phép giả định rằng các gen tại vùng đặc biệt 120-kb ở nhiễm sắc thể 3p21.3 của người có thể hợp tác như vùng kiềm chế khối u do hoạt hóa chức năng con đường kiềm chế khối u.
THỬ NGHIỆM LÂM SÀNG XA HƠN
Trị liệu thay thế gen được coi là một tiêu chuẩn đối với chăm sóc sức khỏe
Trị liệu thay thế gen nhanh chóng trở thành hiện thực với tầm ảnh hưởng tới cả một quần thể nói chung trong tương lai. Vì thế, dường như thời điểm giải quyết các vấn đề xã hội đã tác động mạnh mẽ tới thành bại của việc ứng dụng gen trị liệu. Việc thao tác DNA trong thập kỷ qua đã nảy nở các vấn đề mới và phức tạp thuộc các lĩnh vực xã hội, Y học và khoa học; và các vấn đề xã hội phải được giải quyết một cách thận trọng và toàn diện giống như các vấn đề của khoa học cơ bản và kỹ thuật nếu muốn gen trị liệu giữ vai trò như là phương pháp chuẩn cho việc chăm sóc ung thư. Công nghệ gen trị liệu dù có hoàn hảo đến đâu đi nữa mà công chúng không được biết tới nó thì việc ứng dụng cũng rất hạn chế và những lợi ích thực sự của nó cũng không dễ dàng được chấp nhận.
Để tiến tới việc chấp nhận công nghệ mới và đôi khi có tính ép buộc này chắc chắn sẽ phải vượt qua nhiều trở ngại khi phát triển các chiến lược khoa học. Có những dấu hiệu báo trước về sự lúng túng xung quanh mọi thao tác gen. Thậm chí ngay cả những vấn đề không liên quan gì tới việc chuyển gen tới người cũng vẫn bị chần chừ cho đến tận khi khoa học Y học đảm bảo chắc chắn với cộng đồng là gen trị liệu là an toàn và các nhà khoa học sẽ chịu trách nhiệm về những ứng dụng này. Việc ra các thông báo chính xác (cả dương tính và âm tính) các kết quả thử nghiệm lâm sàng và những tranh cãi trung thực về các giới hạn cũng như những hứa hẹn của gen trị liệu là rất quan trọng. Ở Hoa Kỳ, bước chính thức xúc tiến truyền thông này được thực hiện vào năm 1974 khi ủy ban cố vấn DNA tái tổ hợp (RAC) của NIH được thành lập để trả lời công chúng các vấn đề liên quan tới độ an toàn của thao tác gen. Tất cả các protocol lâm sàng của DNA tái tổ hợp muốn được thực hiện ở các học viện được nhận quỹ từ liên bang đều phải đệ trình tới RAC để được phê chuẩn. Các tác dụng phụ đối nghịch cũng phải đệ trình và phải được các nhà nghiên cứu, thầy thuốc và công chúng chấp thuận cho sử dụng.
Muốn sử dụng những thông tin này cũng như chấp nhận những bằng chứng từ các thử nghiệm lâm sàng đòi hỏi phải am hiểu cơ bản về các khái niệm sinh học phân tử - một cái gì đó mà nhiều bệnh nhân không thể có được. Am hiểu vấn đề này là rất cần thiết đối với bệnh nhân và gia đình của họ để đề xuất được các quyết định tại thời điểm chẩn đoán ung thư. Việc tuyên truyền giáo dục có thể được áp dụng với từng cá nhân để họ có thể hiểu và thông cảm về những ảnh hưởng tiềm ẩn của gen trị liệu đến chất lượng cuộc sống. Cũng cần phải thay đổi tư tưởng của công chúng, cộng đồng y học và những người làm công tác quản lý để có nhứng quyết định đúng nhất về sự phát triển công nghệ gen trị liệu, sao cho phù hợp với đạo đức sinh học.
KẾT LUẬN
Mặc dầu những tiên đoán bước đầu về tiềm năng ứng dụng của trị liệu TSG đối với ung thư vẫn chưa lạc quan lắm, nhưng việc chuyển gen bằng virus cho thấy hiệu ứng ở các TB ung thư cao hơn các TB mô bình thường, các vec tơ virus lan tỏa rất nhanh xuyên qua khối u và gây chết TB theo cơ chế apoptosis. Biểu hiện gen sau khi tiêm được ghi lại trong các tài liệu là nó xảy ra ngay cả khi có đáp ứng miễn dịch kháng adenovirus. Các thử nghiệm lâm sàng về thay thế gen p53 đã chứng minh rằng khi tiêm trực tiếp vào khối u có thể làm thoái lui chúng hoặc kéo dài sự ổn định các bệnh cục bộ. Với độc tính thấp của chuyển gen nên việc thay thế TSG có thể dễ dàng kết hợp cùng với các phương pháp điều trị khác. Những lo ngại ban đầu cho rằng sự đa dạng của các tổn thương trong các TB ung thư sẽ ngăn cản việc ứng dụng gen trị liệu ung thư là không có cơ sở. Ngược lại, việc sửa chữa các tổn thương do gen đơn có thể được lặp đi lặp lại nhiều lần thì sẽ làm thoái lui đáng kể các khối u. Những thắng lợi thu được ở các thử nghiệm lâm sàng trước đó về thay thế gen p53 đã cung cấp những thông tin hữu ích cho việc thiết kế các chiến lược gen trị liệu tương lai.
Mặc dầu đã có những kết quả hiển nhiên trong thử nghiệm lâm sàng về thay thế gen TSG, nhưng cũng cần phải nhận rõ rằng vẫn còn những lỗ hổng về kiến thức và kỹ thuật. Những lỗ hổng này cần phải lấp đầy thì mới có được các chiến lược trị liệu gen hay nhất. Những khối u không thể cắt bỏ được là vấn đề nổi cộm trong ung thư học, với các trị liệu đã được trắc nghiệm như xạ trị và hóa trị mới chỉ kiểm soát được dưới 50% ung thư phổi. Mặc dù hiện nay có vướng mắc về mặt kỹ thuật gây cản trở cho việc ứng dụng gen trị liệu đối với ung thư, nhưng với việc phát triển các vec tơ hiệu ứng hơn, các gen mới kết hợp với các phương thức tiếp cận mới thì đó vẫn là chân trời mới và là hy vọng trong việc ứng dụng gen trị liệu các bệnh ung thư. Nhiều công trình nghiên cứu đã chứng minh tiềm năng to lớn của việc kết hợp trị liệu TSG với dược phẩm, miễn dịch và trị liệu phóng xạ sẽ tiêu diệt các TB ung thư hiệu quả hơn với số lượng lớn hơn. Trị liệu thay thế TSG nhằm vào gốc rễ của bệnh nên có thể nó sẽ là chiến lược tiềm năng đối với việc phòng chống ung thư.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









