️ Sổ tay Hướng dẫn thực hành tiêm chủng vắc xin phòng COVID-19 (Comirnaty của Pfizer – BioNTech) (P3)
Thống kê, báo cáo
Trong thời gian tới sẽ có thêm nhiều loại vắc xin phòng COVID-19 được đưa vào triển khai tại Việt Nam, do vậy các địa phương cần quản lý hiệu quả việc triển khai theo từng đợt (Quyết định phân bổ vắc xin của Bộ Y tế) và theo từng loại vắc xin COVID-19. Để công khai minh bạch thông tin và tạo điều kiện thuận lợi cho các cá nhân, tổ chức, đơn vị, địa phương trong quá trình triển khai chiến dịch tiêm vắc xin phòng COVID-19, các đơn vị, địa phương sử dụng Nền tảng quản lý tiêm chủng COVID-19 để triển khai chiến dịch. Thông qua việc sử dụng Hệ thống quản lý Thông tin tiêm chủng Quốc gia (https://tiemchung.vncdc.gov.vn) hoặc Ứng dụng Sổ sức khỏe điện tử (https://hssk.kcb.vn), các đơn vị triển khai thực hiện như sau:
Quản lý đối tượng tiêm chủng COVID-19:
Nhập trực tiếp từng đối tượng tiêm chủng COVID-19 trên hệ thống.
Tải danh sách các đối tượng gồm có thông tin cá nhân, lịch sử tiêm chủng vắc xin COVID-19 lên hệ thống thông qua tính năng Import trong mục quản lý đối tượng.
Lập kế hoạch tiêm chủng vắc xin COVID-19 cho những đối tượng đã được quản lý trên hệ thống.
Thực hiện quy trình tiêm chủng 4 bước trên Hệ thống gồm: Đón tiếp → Khám sàng lọc → Tiêm chủng → Theo dõi sau tiêm.
Quản lý vắc xin, vật tư tiêm chủng vắc xin COVID-19 trên hệ thống.
Báo cáo tiêm chủng COVID-19:
Việc thực hiện báo cáo kết quả triển khai tiêm chủng văc xin phòng COVID-19 được triển khai từ khi đơn vị bắt đầu tiêm cho đến khi kết thúc đợt tiêm chủng, gồm các báo cáo sau:
Báo cáo hàng ngày:
Tổng hợp báo cáo hàng ngày kết quả triển khai tiêm chủng (phụ lục 6);
Tổng hợp danh sách trường hợp tai biến nặng sau tiêm (phụ lục 7);
Báo cáo kết thúc đợt tiêm: được thực hiện trong vòng 5 ngày sau khi kết thúc triển khai (phụ lục 8).
Các đơn vị thực hiện báo cáo tiêm chủng COVID-19 như sau:
Với các đơn vị triển khai tiêm chủng: Sử dụng tính năng Báo cáo tiêm chủng COVID để báo cáo Kết quả tiêm chủng hàng ngày và danh sách các trường hợp tai biến nặng sau tiêm chủng. Thực hiện báo cáo theo từng đơn vị, từng đợt triển khai (theo Quyết định của Bộ Y tế) và từng loại vắc xin triển khai.
Với các đơn vị không thực hiện tiêm chủng: Quản lý đối tượng tiêm (danh sách tại phụ lục 1) và Báo cáo kết thúc đợt tiêm chủng trong vòng 5 ngày sau ngày tiêm cuối (phụ lục 8).
Lưu ý với các đơn vị:
Lựa chọn vào báo cáo đúng đợt triển khai tại đơn vị, tương ứng với Quyết định phân bổ vắc xin của Bộ Y tế đã ban hành.
Thực hiện đúng thời gian quy định việc nhập báo cáo hàng ngày trên Hệ thống:
Đối với đơn vị triển khai tiêm chủng (Tuyến xã, bệnh viện, cơ sở triển khai tiêm chủng...): Thực hiện rà soát và báo cáo trước 17 giờ 00.
Đối với tuyến quận/huyện (Trung tâm Y tế quận/huyện): Rà soát báo cáo của tuyến dưới, thực hiện gửi báo cáo trước 17 giờ 30.
Đối với tuyến tỉnh/thành phố (CDC tỉnh/TP): Rà soát báo cáo của tuyến dưới, thực hiện gửi báo cáo trước 18 giờ 00.
Văn phòng TCMR Khu vực (Viện Vệ sinh dịch tễ/Pasteur): Rà soát báo cáo của các tuyến, thực hiện báo cáo trước 18 giờ 30.
Các đơn vị thực hiện báo cáo Tổng hợp kết quả tiêm vắc xin phòng COVID-19 sau khi kết thúc đợt tiêm chủng trong vòng 5 ngày cho Văn phòng TCMR Quốc gia và Khu vực (Phụ lục 8).
PHỤ LỤC
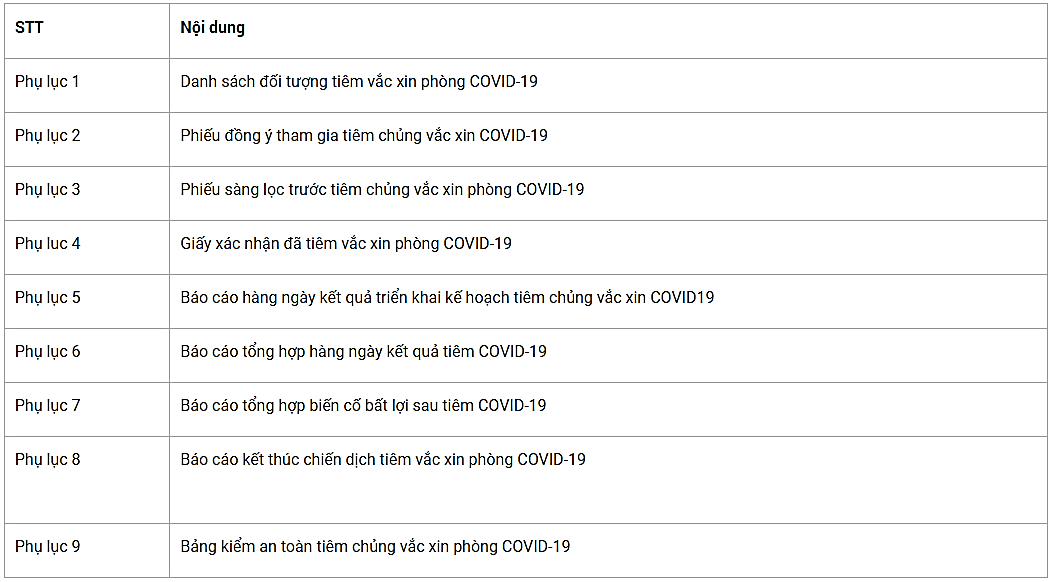
Phụ lục 1
DANH SÁCH ĐỐI TƯỢNG TIÊM VẮC XIN PHÕNG COVID-19
Tỉnh:….............. Huyện:…........................
Xã:…................. Điểm tiêm chủng:…................

*: BẮT BUỘC PHẢI ĐIỀN
Mã nhóm đối tượng ưu tiên: (1) Lực lượng tuyến đầu phòng chống dịch; (2) Nhân viên, cán bộ ngoại giao của Việt Nam được cử đi nước ngoài; hải quan, cán bộ làm công tác xuất nhập cảnh; (3) Người cung cấp dịch vụ thiết yếu: hàng không, vận tải, du lịch; cung cấp dịch vụ điện, nước...; (4) Giáo viên, người làm việc tại các cơ sở giáo dục, đào tạo; người làm việc tại các cơ quan, đơn vị hành chính thường xuyên tiếp xúc với nhiều người; (5) Người mắc các bệnh mạn tính, người trên 65 tuổi; (6) Người sinh sống tại các vùng có dịch; (7) Người nghèo, các đối tượng chính sách xã hội; (8) Người được cơ quan nhà nước có thẩm quyền cử đi công tác, học tập, lao động ở nước ngoài; (9) Các đối tượng khác do Bộ Y tế quyết định căn cứ yêu cầu phòng chống dịch; (10) Nhóm khác, ghi rõ…......
…......., Ngày........tháng ....năm 202…

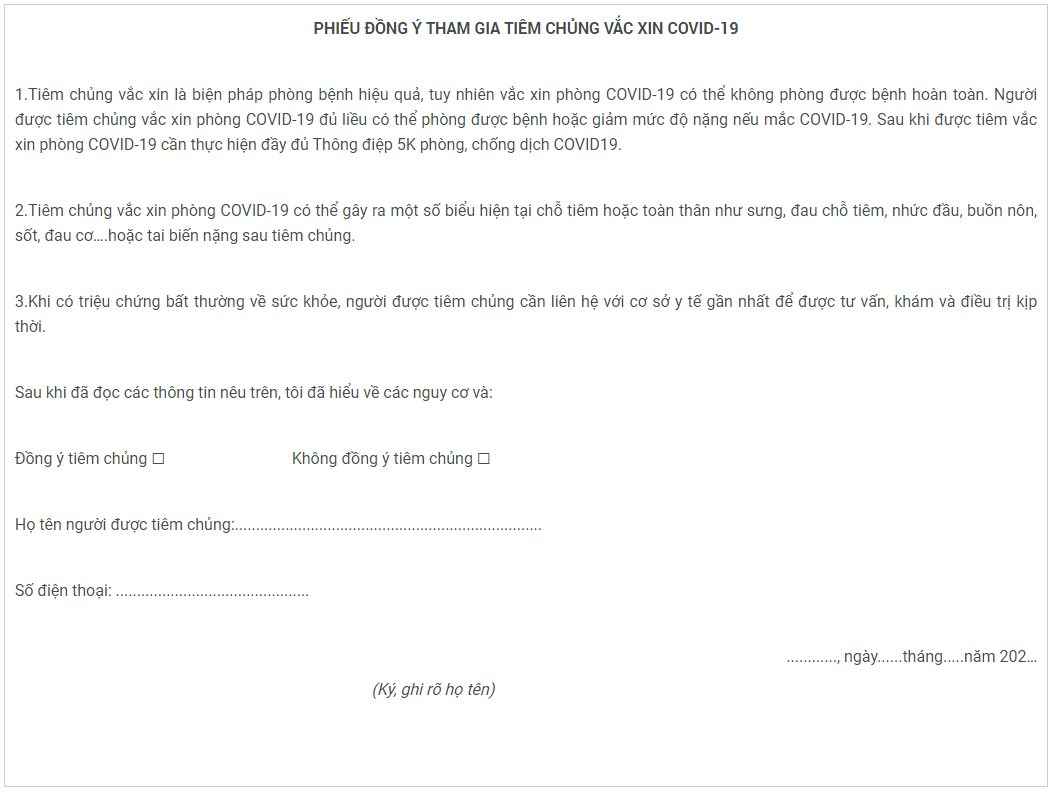
Phụ lục 2:
(Ban hành kèm theo văn bản số 1734/BYT-DP ngày 17/03/2021)
Phụ lục 3
(Ban hành kèm theo Quyết định số 3445/QĐ-BYT ngày 15/7/2021)

PHIẾU SÀNG LỌC TRƯỚC TIÊM CHỦNG VẮC XIN PHÒNG COVID-19
Họ và tên:…………………………………………..………………………… …. Nam □ Nữ □
Ngày tháng năm sinh……………….…………………......................................................
Nghề nghiệp:..............................................................................................................................................
Đơn vị công tác: ........................................................................................................................................
Địa chỉ: ...................................................................................Số điện thoại: ............................................
I.Sàng lọc:
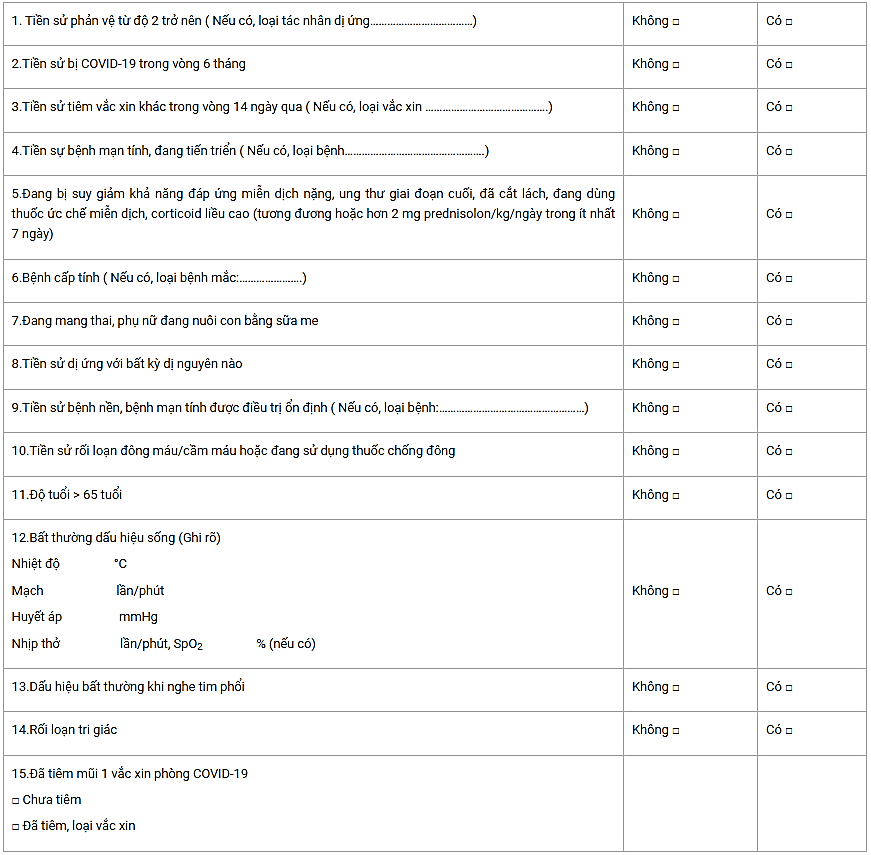
II.Kết luận
Đủ điều kiện tiêm chủng ngay (Tất cả đều KHÔNG có điểm bất thường).
Chống chỉ định tiêm chủng vắc xin cùng loại (Khi CÓ điểm bất thường tại mục 1).
Trì hoãn tiêm chủng (Khi CÓ bất kỳ điểm bất thường tại mục 2, 3, 4, 5, 6, 7).
Chuyển tiêm chủng và theo dõi tại bệnh viện (Khi CÓ tại mục 8, 9, 10, 11, 12, 13, 14).
Đề nghị chuyển đến……………………………….
Lý do:…………………………………………………

Phụ lục 4
(Ban hành kèm theo văn bản số 1734/ BYT-DP ngày 17/03/2021)

Phụ lục 5
(Ban hành kèm theo Quyết định số 1734/QĐ-BYT ngày 17/03/2021)
Mẫu
BÁO CÁO HÀNG NGÀY KẾT QUẢ TRIỂN KHAI KẾ HOẠCH TIÊM CHỦNG VẮC XIN COVID-19
(Dành cho cơ sở thực hiện tiêm chủng báo cáo)
Tỉnh/TP.............................. Quận/huyện ............................
Cơ sở tiêm chủng...............
Tổng số đối tượng đăng kí tiêm chủng: .........., Ngày ......../......./........

Ghi chú: Nếu 1 cơ sở tổ chức tiêm cho nhiều đơn vị thì sử dụng bảng dưới đây:
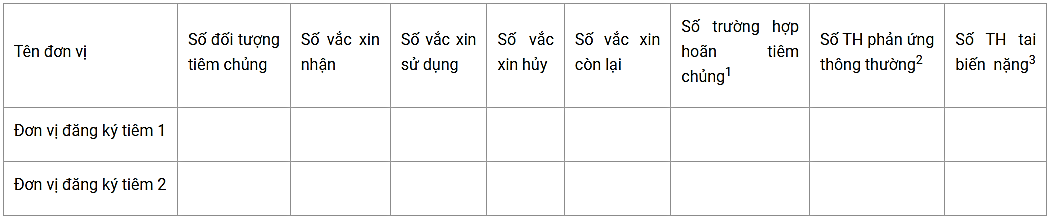
Báo cáo trường hợp hoãn tiêm chủng
Số trường hợp hoãn tiêm: .......................
Lý do khác:................................................
Báo cáo cụ thể các trường hợp phản ứng thông thường

Báo cáo trường hợp tai biến nặng sau tiêm chủng:
Liệt kê các trường hợp và mô tả ngắn gọn từng trường hợp:
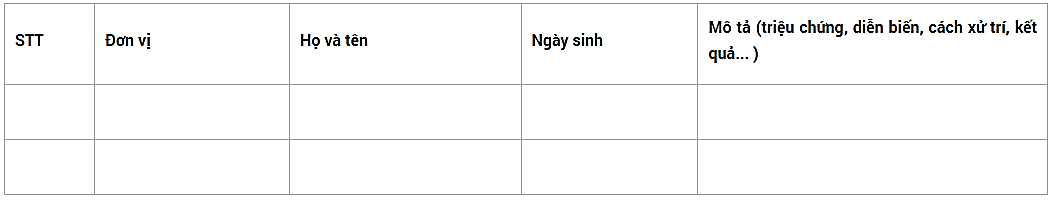
Từng trường hợp được báo cáo chi tiết theo phiếu điều tra tai biến nặng sau tiêm chủng tại thông tư 34/2018/TT – BYT ngày 12 tháng 11 năm 2018.
Ngày ...........tháng ........năm 2021

Phụ lục 6: BÁO CÁO TỔNG HỢP HÀNG NGÀY CỦA TUYẾN TỈNH

TỔNG HỢP BÁO CÁO HÀNG NGÀY KẾT QUẢ TRIỂN KHAI TIÊM CHỦNG VẮC XIN PHÕNG COVID-19
Thời gian bắt đầu triển khai: Ngày ......../....../2021
Ngày báo cáo: ….../…...../2021

*: Đợt tiêm: Tính theo Quyết định của Bộ Y tế (Đơt 5: QĐ 2971/QĐ-BYT ngày 17/6/2021; Đợt 6: QĐ 3020/QĐ-BYT ngày 23/6/2021).
**: Số vắc xin sử dụng nguyên lọ (liều) (VD1: lọ vắc xin 10 liều đã mở, sử dụng để tiêm chủng cho 9 người, còn 1 liều trong lọ sau buổi tiêm chủng thì số sử dụng báo cáo là 10 liều. VD2: lọ vắc xin 10 liều đã mở, sử dụng để tiêm chủng cho 11 người thì số sử dụng báo cáo là 10 liều).
***: Số ca phản ứng nhẹ được ghi nhận trong ngày nhưng có thể bao gồm các ca được tiêm chủng trước ngày báo cáo. Một người có nhiều triệu chứng chỉ ghi nhận 1 trường hợp ở cột này.
****: Trường hợp xác định là phản ứng nặng thì bắt buộc phải có thông tin báo cáo để nhập vào danh sách "PL 2". Đề nghị Hội đồng chuyên môn cấp tỉnh tổ chức họp và đánh giá, xác định, phân loại ca phản ứng sớm trong vòng 5 ngày kể từ khi nhận báo cáo theo quy định.

Phụ lục 7: TỔNG HỢP BIẾN CỐ BẤT LỢI CỦA TUYẾN TỈNH
Phụ lục 2:

TỔNG HỢP BÁO CÁO HÀNG NGÀY TRƯỜNG HỢP TAI BIẾN NẶNG SAU TIÊM CHỦNG VẮC XIN PHÒNG COVID-19
Thời gian bắt đầu triển khai: Ngày ……../…….../2021
Ngày báo cáo: …....../…......./2020


Phụ lục 8:

Ngày tháng năm 2021
BÁO CÁO KẾT QUẢ TRIỂN KHAI TIÊM CHỦNG VẮC XIN PHÒNG COVID-19
ĐỢT ……..
I.KẾT QUẢ
Kết quả chung:
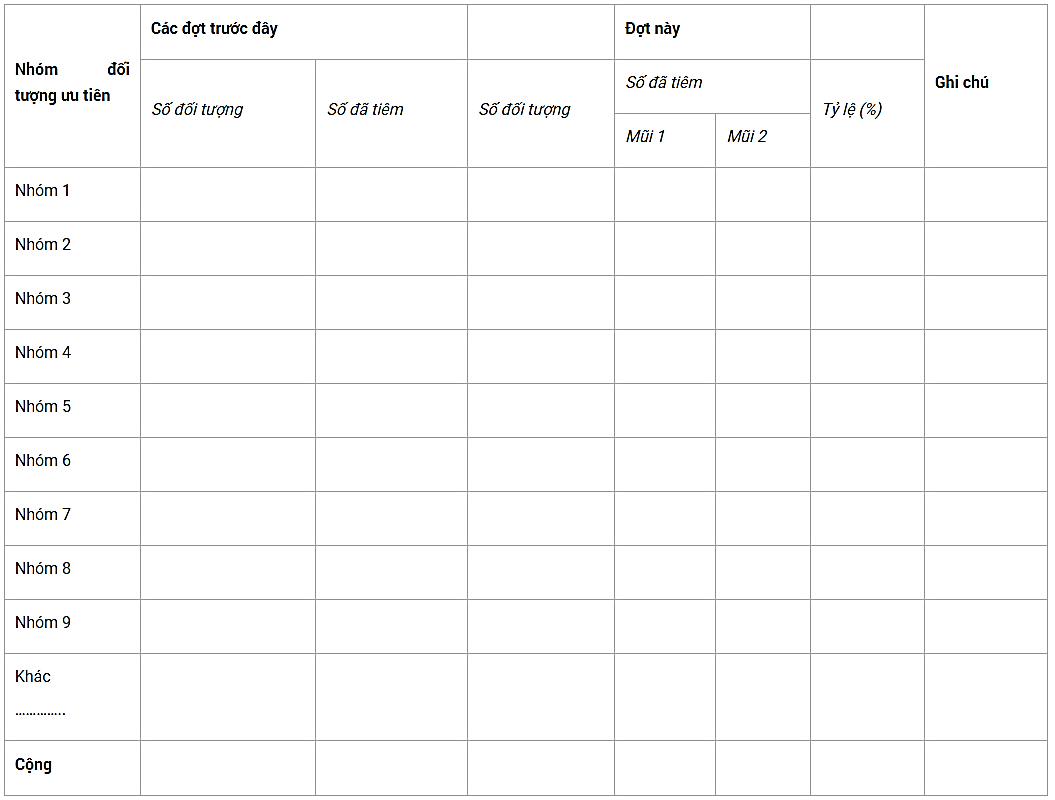
Kết quả theo đơn vị:

II.PHẢN ỨNG SAU TIÊM VẮC XIN PHÕNG COVID-19

III.TỔ CHỨC THỰC HIỆN
1.Công tác chỉ đạo
-
-
-
2.Tổ chức thực hiện
2.1. Thời gian triển khai
Thời gian chung triển khai trên địa bàn: Từ ngày … tháng … năm 2021 đến ngày … tháng … năm 2021
Tổng số điểm tiêm chủng: ……….., trong đó:
Số điểm tiêm chủng tại trạm:……..;
Số điểm tiêm chủng tại Bệnh viện:……..;
Số điểm tiêm chủng lưu động:…..…; -
Số cơ sở tiêm chủng:
Bệnh viện tuyến TW/Khu vực/Tỉnh/Bộ ngành/ĐHY: ……. cơ sở;
Bệnh viện/Trung tâm Y tế huyện…………. cơ sở;
Phòng khám đa khoa……………. cơ sở;
Trạm Y tế…………. cơ sở;
Cơ sở tiêm chủng dịch vụ…………. cơ sở;
Cơ sở khám chữa bệnh tư nhân…………. cơ sở; o
Điểm tiêm chủng lưu động…………. cơ sở;
Khác (ghi rõ)…………………………………..………...…. cơ sở;
2.2. Hoạt động truyền thông

2.3. Cung cấp vắc xin, vật tư
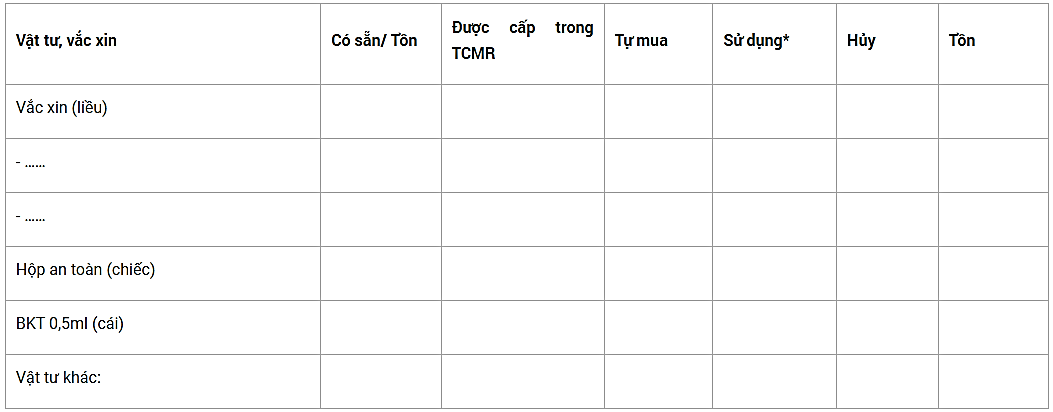
*: Số liều vắc xin đã tiêm cho đối tượng và số liều còn lại trong các lọ đã mở nhưng không sử dụng hết được tính vào số sử dụng.
2.4. Kinh phí
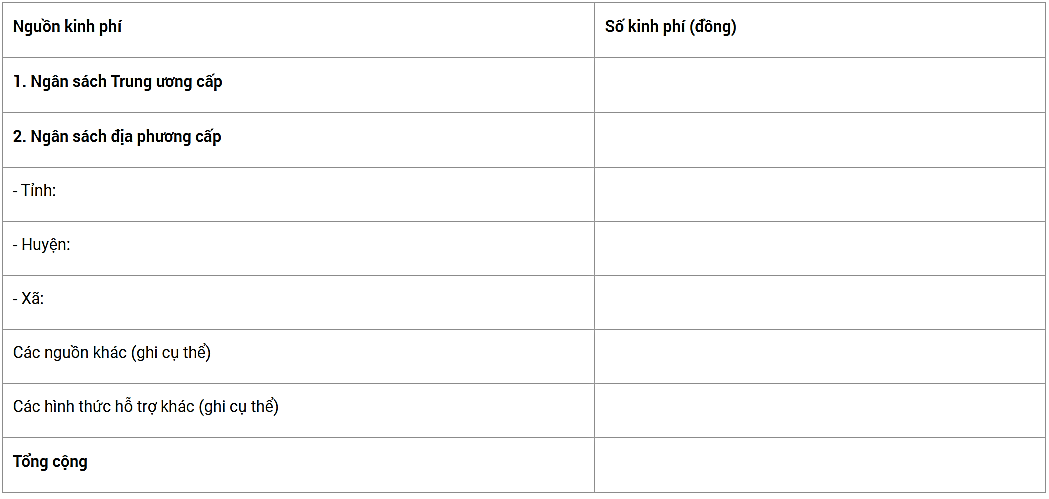
2.5. Công tác giám sát và nhân lực triển khai
a.Công tác giám sát
Tuyến tỉnh: Số lượt giám sát: ………lượt; Số người giám sát: ……. người; số điểm giám sát: ……. điểm
Tuyến huyện: Số lượt giám sát: ……. lượt; Số người giám sát: …… người; số điểm giám sát: …….. điểm
Các vấn đề phát hiện trong quá trình giám sát:
+
+
+
Các vấn đề đã được giải quyết:
+
+
+
b.Nhân lực trực tiếp tham gia
IV.NHỮNG THUẬN LỢI VÀ KHÓ KHĂN
Thuận lợi
-
-
-
Khó khăn
-
-
-
V.NHẬN XÉT VÀ ĐỀ NGHỊ
-
-
-

PHỤ LỤC 9:
Bảng kiểm an toàn tiêm chủng vắc xin phòng COVID-19
(Theo phụ lục văn bản số 5488/BYT-KCB ngày 09/7/2021)

TÀI LIỆU THAM KHẢO
Chính phủ Việt Nam (2021) Nghị quyết số 21/NQ-CP ngày 26 tháng 02 năm 2021 của Thủ tướng Chính phủ về mua và sử dụng vắc xin phòng COVID-19.
Chính phủ Việt Nam (2017) Nghị định số 104/NĐ-CP ngày 1/7/2016 của Thủ tướng Chính phủ qui định về hoạt động tiêm chủng.
Chính phủ Việt Nam (2018) Nghị định 155/2018/NĐ-CP ngày 12/11/2018 sửa đổi bổ sung một số qui định của Nghị định 104/NĐ-CP ngày 1/7/2016.
Bộ Y tế (2021), Quyết định số 3355/QĐ-BYT ngày 08 tháng 07 năm 2021 về việc phê duyệt kế hoạch triển khai chiến dịch tiêm vắc xin phòng COVID-19 năm 20212022.
Bộ Y tế (2021), Quyết định số 1464/QĐ-BYT ngày 05 tháng 03 năm 2021 về việc ban hành Hướng dẫn tiếp nhận, bảo quản, phân phối và sử dụng vắc xin phòng COVID-19.
Bộ Y tế (2021), Văn bản số 1734/BYT-DP ngày 17/3/2021 Hướng dẫn tổ chức buổi tiêm chủng vắc xin phòng COVID-19.
Bộ Y tế (2021), Quyết định số 2995/QD-BYT ngày 18/6/2021 Hướng dẫn tạm thời.
Khám sàng lọc trước tiêm chủng vắc xin phòng COVID-19.
Bộ Y tế (2021), Quyết định số 3445/QD-BYT ngày 15/7/2021 Hướng dẫn sửa đổi, bổ sung Hướng dẫn tạm thời khám sàng lọc trước tiêm chủng vắc xin phòng COVID-19.
Bộ Y tế (2021), Quyết đinh số 1966/QĐ-BYT ngày 22/4/2021 về Hướng dẫn chẩn đoán và điều trị Hội chứng giảm tiểu cầu, huyết khối sau tiêm vắc xin phòng COVID-19.
Văn bản số 3886/BYT-DP ngày 11/05/2021 “Hướng dẫn giám sát sự cố bất lợi sau tiêm vắc xin phòng COVID-19”.
Văn bản số 4198/BYT-KCB ngày 22/05/2021 về việc Triển khai công tác an toàn tiêm chủng vắc xin phòng COVID-19”.
Quyết định 3348/QĐ-BYT ngày 08/7/2021 Hướng dẫn chẩn đoán và điều trị viêm cơ tim sau tiêm chủng vắc xin phòng COVID-19.
Văn bản số 5488/BYT-KCB ngày 09/7/2021 về Hướng dẫn đảm bảo an toàn tiêm chủng vắc xin phòng COVID-19.
Bộ Y tế (2020) Thông tư 24/2018/TT-BYT ngày 18/9/2018 và Thông tư 05/TT-BYT ngày 3/4/2020 qui định về tổ chức hoạt động của Hội đồng Tư vấn chuyên môn đánh giá tai biến nặng sau tiêm chủng.
Bộ Y tế (2017), Thông tư 34/2018/TT-BYT ngày 12/11/2018 qui định một số điều của Nghị định 104/NĐ-CP ngày 1/7/2016.
Bộ Y tế (2017), Thông tư 51/2017/TT-BYT ngày 29 tháng 12 năm 2017 Hướng dẫn phòng, chẩn đoán, xử trí phản vệ.
Dự án Tiêm chủng mở rộng Quốc gia (2017), Thực hành tiêm chủng, Tài liệu hướng dẫn cán bộ y tế (dựa theo hướng dẫn của Tổ chức Y tế Thế giới).
Thông tin từ US CDC https://vietnamese.cdc.gov/coronavirus/2019ncov/vaccines/different-vaccines/Pfizer-BioNTech.html.
COVID-19 mRNA Vaccines – Immunization Action Coalition • Saint Paul, Minnesota • 651-647-9009 www.vaccineinformation.org.
WHO-HQ, 27 May 2021; COMIRNATY® (Tozinameran - COVID-19 mRNA Vaccine), produced by BioNTech Manufacturing GmbH, a World Health Organization (WHO) recommended vaccine through WHO Emergency Use Listing (EUL) procedure Variation to extend the storage conditions at 2-8°C for 1 month (31 days).
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh






