️ Triển vọng thuốc mới điều trị Covid-19: MOLNUPIRAVIR
Biên dịch: DS. Vũ Thu Thảo – Tổ Dược lâm sàng – Khoa Dược, Bệnh viện Nguyễn Tri Phương
Giới thiệu về hoạt chất Molnupiravir
Hiện có 24 phương pháp điều trị coronavirus được nhắc đến nhiều nhất (Hình 1). Trong khi một số đang tích lũy bằng chứng rằng chúng có hiệu quả, hầu hết vẫn đang ở giai đoạn đầu của nghiên cứu. Hiện vẫn chưa có cách chữa trị cho COVID-19. Chỉ có một phương pháp điều trị, một loại thuốc có tên là remdesivir, đã được Hoa Kỳ phê duyệt đối với căn bệnh này và nghiên cứu cho thấy nó có thể chỉ mang lại lợi ích khiêm tốn cho bệnh nhân. Các nhà khoa học cũng đang nghiên cứu một loạt các phương pháp điều trị tiềm năng khác, nhưng hầu hết vẫn đang trong giai đoạn nghiên cứu ban đầu (1).

Hình 1. 24 phương pháp điều trị đang được theo dõi, đánh giá về hiệu quả và an toàn trong điều trị COVID-19
Ý nghĩa của các nhãn theo phân loại của NYTimes
Molnupiravir là một trong 13 ứng cử viên điều trị COVID-19 được xếp vào loại đang được “thăm dò và dữ liệu chưa rõ”. Molnupiravir (còn được gọi là EIDD-2801/MK-4482) là một thuốc chống virus sử dụng qua đường uống so với remdesivir (đã được US-FDA công nhận cho điều trị COVID) phải dùng đường tiêm tĩnh mạch, đã và đang được thử nghiệm ban đầu để chống lại virus cúm, nhưng hiện nay đang được thử nghiệm để điều trị bệnh nhân COVID-19.
Thuốc này được phát triển ở Đại Học Emory do công ty DRIVE (Drug Innovation Ventures at Emory) ở Mĩ. Sau đó vào tháng 01-2020 được công ty Ridgeback Biotherapeutics mua lại và kết hợp với Merk&Co đồng phát triển và sở hữu bằng sáng chế dưới tên là EIDD-2801 (Emory Institute for Drug Development).
Molnupiravir là tiền chất của chất tương tự ribonucleoside β-D-N4-hydroxycytidine (NHC; EIDD-1931), có tiềm năng điều trị nhiễm trùng do nhiều RNA virus gây ra, bao gồm coronavirus độc lực cao và virus cúm và các alphavirus gây bệnh não như virus viêm não ngựa ở Venezuela dựa trên các nghiên cứu mô hình trong phòng thí nghiệm (không phải nghiên cứu trên người).
Cơ chế tác dụng
Molnupiravir nhanh chóng được phân cắt trong huyết tương thành EIDD-1931, sau đó phân bố vào các mô khác nhau, được chuyển đổi thành 5′-triphosphat có hoạt tính (Hình 2). Chất tạo thành EIDD-1931-5′-triphosphate này là chất nền thay thế cạnh tranh cho RNA polymerase phụ thuộc vào RNA được mã hóa của virus và khi được gắn vào RNA trung tâm của virus, nó gây ra tác dụng kháng virus thông qua “thảm họa lỗi virus” (viral error catastrophe), một khái niệm được dự đoán về việc tăng tỷ lệ đột biến của virus vượt quá ngưỡng có thể dung nạp được về mặt sinh học, dẫn đến suy giảm khả năng hoạt động của virus dẫn đến virus bị tiêu diệt (2).
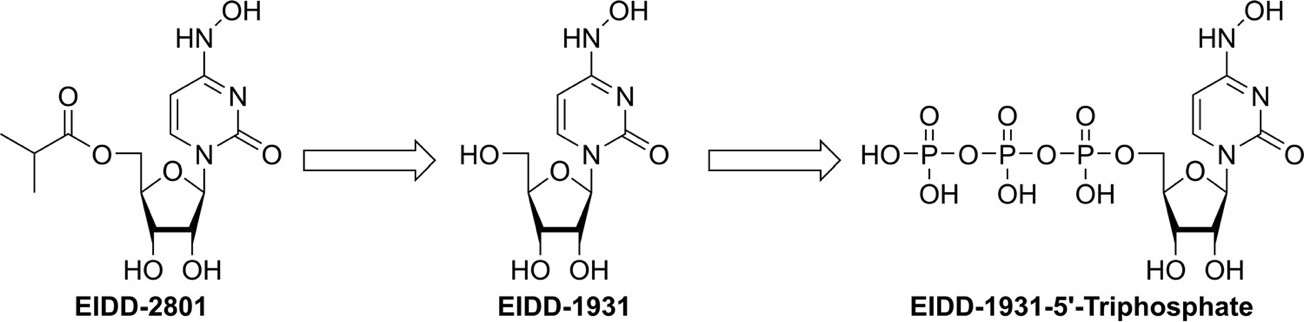
Hình 2. Molnupiravir được chuyển đổi nhanh chóng trong huyết tương thành EIDD-1931 (NHC), sau khi phân bố vào các mô khác nhau sẽ được chuyển đổi bởi kinase vật chủ thành EIDD-1931-5′-triphosphate, tác nhân kháng virus hoạt động.
Các nghiên cứu tiền lâm sàng trong phòng thí nghiệm trên tế bào hoặc động vật
Molnupiravir đã chứng minh hoạt tính in vitro (trong phòng thí nghiệm - chưa phải nghiên cứu trên người) chống lại coronavirus hội chứng hô hấp cấp tính nặng 2 (SARS-CoV-2) trong nuôi cấy tế bào biểu mô đường thở ở người.
Việc sử dụng molnupiravir dự phòng và điều trị cho những con chuột bị nhiễm coronavirus hội chứng hô hấp cấp tính nặng (SARS-CoV) hoặc coronavirus hội chứng hô hấp Trung Đông (MERS-CoV) đã cải thiện chức năng phổi, giảm hiệu giá virus.
Trong mô hình bệnh cúm ở chồn, việc điều trị dịch virus cúm A bằng molnupiravir đã làm giảm sự phát tán của virus và sự thâm nhiễm tế bào viêm trong dịch rửa mũi, với đáp ứng dịch thể kháng virus bình thường (2).
Các nghiên cứu trên người
Nghiên cứu pha 1 trên người khỏe mạnh
Trong nghiên cứu pha 1, liều đơn và đa liều molnupiravir được đánh giá đầu tiên trên người trong nghiên cứu ngẫu nhiên, mù đôi, có đối chứng với giả dược trên người tình nguyện khoẻ mạnh, bao gồm đánh giá ảnh hưởng của thức ăn đối với dược động học. EIDD-1931 xuất hiện nhanh chóng trong huyết tương, thời gian trung bình đạt nồng độ tối đa 1.00 đến 1.75 giờ sau khi uống và thời gian đào thải (T1/2) vào khoảng 1 giờ; thời gian đào thải chậm hơn sau khi dùng nhiều liều hoặc dùng liều đơn cao hơn (7.1 giờ ở liều cao nhất đã thử nghiệm). Nồng độ tối đa Cmax và diện tích phân bố dưới đường cong (AUC) thay đổi tỷ lệ thuận với liều uống và không có sự tích tích tụ sau khi dùng nhiều liều. Khi dùng cùng với thức ăn làm giảm tốc độ hấp thu nhưng không giảm phơi nhiễm tổng thể (2).
Molnupiravir được dung nạp tốt, dưới 50% người uống được báo cáo có tác dụng phụ nhưng 93.3% đều nhẹ, tỷ lệ tác dụng phụ cao hơn khi dùng giả dược. Một số đối tượng phải ngừng thử nghiệm vì bị nổi ban. Không có tác dụng phụ nghiêm trọng cũng như không có thay đổi sinh hiệu, lâm sàng, xét nghiệm và điện tâm đồ ECG (2).
Nghiên cứu pha 2, 3 trên bệnh nhân nhiễm COVID-19
Dựa trên phân tích tạm thời dữ liệu từ pha 2, phần tìm liều của 2 thử nghiệm đang diễn ra ở pha 2/3, Merck và Ridgeback Biotherapeutics đã quyết định tạm dừng nghiên cứu MOVe-IN đối với bệnh nhân COVID-19 nhập viện và tiếp tục với pha 3 của nghiên cứu MOVe-OUT ở bệnh nhân ngoại trú với COVID-19 (3).
MOVe-IN là một nghiên cứu ngẫu nhiên, đối chứng với giả dược, mù đôi, nghiên cứu pha 2/3 thử nghiệm đa vị trí nhằm đánh giá hiệu quả, an toàn và dược động học của molnupiravir dùng đường uống ở những người tham gia nằm viện ít nhất 18 tuổi nhiễm COVID-19 được phòng thí nghiệm xác nhận và triệu chứng khởi phát trong vòng 10 ngày trước khi phân nhóm ngẫu nhiên. Pha 2 của thử nghiệm thu hút 304 người tham gia phân theo tỷ lệ ngẫu nhiên 1:1:1:1 để nhận liều molnupiravir 200mg, 400mg, 800mg hoặc giả dược hai lần mỗi ngày trong 5 ngày. Sau khi phân tích dữ liệu tạm thời, kết luận rằng nghiên cứu không có khả năng chứng minh lợi ích lâm sàng ở bệnh nhân nhập viện. Quyết định tạm dừng nghiên cứu (4).
MOVe-OUT là một nghiên cứu ngẫu nhiên, đối chứng với giả dược, mù đôi, nghiên cứu pha 2/3 điều tra hiệu quả và tính an toàn của molnupiravir. Điều tra ở những bệnh nhân không nằm viện trên 18 tuổi nhiễm COVID-19 đã được xác nhận và khởi phát triệu chứng trong vòng 7 ngày trước khi phân nhóm ngẫu nhiên. Pha 2 (phần 1) của nghiên cứu bao gồm 302 bệnh nhân được phân ngẫu nhiên theo tỷ lệ 1: 1: 1: 1 để nhận liều molnupiravir 200mg, 400mg, 800mg, hoặc giả dược hai lần mỗi ngày trong 5 ngày. Kết quả từ phần 1 của nghiên cứu MOVe-OUT cho thấy rằng so với giả dược, tỷ lệ bệnh nhân nhập viện và/hoặc tử vong thấp hơn ở nhóm dùng molnupiravir kết hợp. Tuy nhiên, do không có đủ số lượng các số liệu được báo cáo, nên không thể kết luận chắc chắn liệu biện pháp nào có ý nghĩa về hiệu quả lâm sàng (3).
Dữ liệu từ cả hai thử nghiệm MOVe-OUT và MOVe-IN cũng chứng minh rằng molnupiravir dường như ức chế sự nhân lên của virus. So với giả dược, lượng RNA virus giảm nhiều hơn được quan sát thấy ở bệnh nhân được điều trị bằng molnupiravir ở ngày thứ 5 và ngày thứ 10. Ngoài ra, tỷ lệ bệnh nhân được điều trị bằng molnupiravir có RNA virus không phát hiện được ở ngày thứ 10 và ngày thứ 15. Hiệu quả kháng virus lớn hơn với liều 800mg so với liều 200mg và 400mg (3).
Dựa trên các khuyến nghị từ ủy ban giám sát dữ liệu, tiêu chí đưa vào nghiên cứu pha 3 của nghiên cứu MOVe-OUT bao gồm những bệnh nhân có thời gian triệu chứng từ 5 ngày trở xuống và ít nhất 1 yếu tố nguy cơ tiến triển thành bệnh nặng. Merck sẽ bắt đầu thu nhận bệnh nhân vào nghiên cứu pha 3 (Phần 2) của nghiên cứu MOVe-OUT vào cuối tháng 4/đầu tháng 5 năm 2021 và dự kiến sẽ có dữ liệu nghiên cứu vào tháng 9/tháng 10 năm 2021 (3).
Kết luận
Molnupiravir là một ứng cử viên đang được nghiên cứu để điều trị COVID-19. Các dữ liệu sơ bộ trên tế bào, động vật cho thấy kết quả khả quan. Nhưng các nghiên cứu thử nghiệm trên người chỉ mới bắt đầu và chưa được công bố đầy đủ. Cần thêm nhiều nghiên cứu và dữ liệu để đánh giá tiềm năng của hoạt chất mới này trong điều trị COVID-19.
TÀI LIỆU THAM KHẢO
- Katherine J.Wu, Carl Zimer, Jonathan Corum, “Coronavirus Drugs and Treatment Tracker”, July 08/2021.
- Painter WP, Holman W, Bush JA, et al. “Human Safety, Tolerability, and Pharmacokinetics of Molnupiravir, a Novel Broad-Spectrum Oral Antiviral Agent with Activity Against SARS-CoV-2”, Antimicrob Agents Chemother 2021;65(5):e02428–20.
- Brian Park, “Merck Halts Molnupiravir Trial in Hospitalized COVID-19 Patients; Outpatient Study to Continue”, April 15/2021.
- “Merck and Ridgeback Biotherapeutics Provide Update on Progress of Clinical Development Program for Molnupiravir, an Investigational Oral Therapeutic for the Treatment of Mild-to-Moderate COVID-19”, April 15/2021.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh


.png)







