Hemoglobin (Huyết sắc tố)
Hồng cầu
Máu gồm hai phần chính: các tế bào máu (huyết cầu) và huyết tương. Hồng cầu chiếm số lượng lớn nhất trong số các tế bào máu, đồng thời chứa huyết sắc tố (chất làm cho máu có màu đỏ) (1). Hồng cầu chịu trách nhiệm vận chuyển O2 đến các mô, vận chuyển CO2 ra khỏi mô và làm chất đệm pH máu. Các tế bào hồng cầu không có nhân và bào quan nên không thể tổng hợp protein hay thực hiện các phản ứng oxy hóa. Thay vào đó, tế bào chất của hồng cầu là dung dịch chứa protein, hemoglobin và chất điện giải điều hòa sự khuếch tán các chất qua màng tế bào.
Vòng đời của hồng cầu: Các tết bào hồng cầu có thể sống từ 80 đến 120 ngày, sau đó sẽ chết đi và được thay thế bằng hồng cầu mới sinh ra ở tủy xương (1). Hồng cầu có cấu trúc hình đĩa lõm hai mặt, đường kính bình thường khoảng 7,5μm (1 µm = 0.0001 cm). Khi lưu thông qua nơi có diện tích rất nhỏ như mao mạch và hệ võng nội mô ở lách (splenic sinusoids), tế bào hồng cầu có thể co giãn, thu hẹp lại như hình dạng quả ngư lôi với đường kính chỉ 2μm và sau đó trở lại hình đĩa lõm như bình thường(1). Hồng cầu già sẽ mất tính đàn hồi, vướng lại và bị tiêu hủy chủ yếu ở lách và gan.
.png)
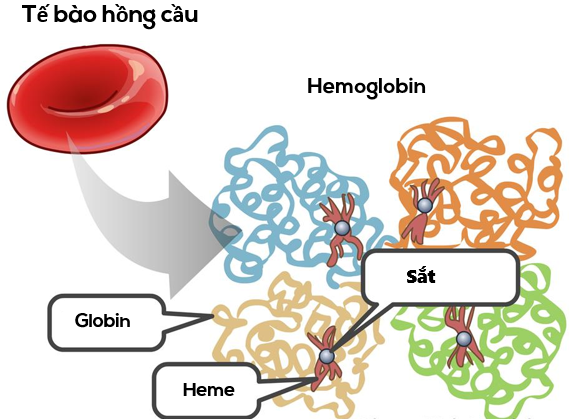
Hemoglobin (Huyết sắc tố - Hb)
Hemoglobin là một protein giàu sắt nằm trong các tế bào hồng cầu, đảm nhiệm chức năng chính của hồng cầu: vận chuyển gần như toàn bộ O2 trong máu. Mỗi phân tử hemoglobin bao gồm bốn tiểu đơn vị, mỗi tiểu đơn vị có một nhóm heme và một chuỗi globin (hemoglobin = heme + globin) (2).
Nhóm heme bao gồm một vòng porphyrin có chứa một nguyên tử sắt (Fe) ở trung tâm. Thông thường, sắt ở trạng thái oxy hóa khử (+2) và có thể liên kết thuận nghịch với O2. Khi nguyên tử sắt trong nhóm heme bị oxy hóa (mất một electron), trạng thái hóa trị của nó thay đổi từ +2 thành +3. Khi đó, hemoglobin được gọi là methemoglobin (metHb) hoặc ferrihemoglobin (Fe +3 không liên kết với O2, đồng nghĩa với việc nó không thể mang O2). Thông thường, lượng hemoglobin ở dạng metHb được duy trì ở mức thấp, khoảng 1%, nhờ enzyme NADH-methemoglobin reductase.(2)
Ở người, có ít nhất 6 gen kiểm soát tổng hợp globin, dẫn đến sự hình thành 6 loại chuỗi polypeptide có cấu trúc khác nhau: α, β, γ, δ, ξ và ς. Tất cả các phân tử hemoglobin bình thường và một số phân tử hemoglobin bất thường đều có bốn phần, bao gồm hai cặp chuỗi polypeptide khác nhau, mỗi chuỗi tạo thành một tiểu đơn vị.(2)
Hemoglobin chủ yếu ở người trưởng thành là HbA, bao gồm hai chuỗi α và hai chuỗi β, được kí hiệu là α2β2. Mỗi chuỗi α có 141 axit amin và mỗi chuỗi β có 146 axit amin.(2)
.jpg)
Vận chuyển khí và cân bằng axit-bazơ
Mỗi phân tử hemoglobin có khả năng liên kết tối đa với bốn phân tử O2 tạo thành oxyhemoglobin. Ở nơi có nồng độ O2 cao (như phổi), oxyhemoglobin hình thành, còn nơi có nồng độ O2 thấp (như ở các mô trong quá trình hô hấp) thì oxyhemoglobin sẽ phân tách thành hemoglobin và O2 để cung cấp O2 cho tế bào. Phản ứng giữa O2 với hemoglobin là phản ứng thuận nghịch:
Hb + 4O2 ⇔ Hb.4O2 .
Ở tế bào hồng cầu:
Trong quá trình hô hấp, tế bào sẽ thải ra khí CO2. CO2 khuếch tán vào huyết tương và sau đó vào các tế bào hồng cầu, với sự có mặt của chất xúc tác carbonic anhydrase, hầu hết CO2 sẽ phản ứng với nước trong hồng cầu và tạo thành axit carbonic:
H2O + CO2 ⇔ H2CO3.
Sau đó, axit carbonic phân ly tạo thành các ion H+ và ion bicarbonate HCO3-:
H2CO3 ⇔ H+ + HCO3-.
Sự phân ly của axit carbonic làm tăng tính axit của máu (giảm nồng độ pH). Ion H+ được tạo ra từ phản ứng trên thúc đẩy sự phân ly O2 từ oxyhemoglobin, O2 phân ly ra được dùng để cung cấp cho mô:
Hb.4O2 + H+ ⇔ Hb-H+ + 4O2.
Ở phổi:
Phổi có nồng độ O2 cao sẽ diễn ra quá trình ngược lại. O2 liên kết với Hb-H+ sẽ hình thành Hb-O2 và giải phóng H+. H+ kết hợp lại với HCO3- sẽ tạo CO2 và thải ra ngoài trong quá trình thở. Những phản ứng nhận và giải phóng H+ xảy ra với tốc độ bằng nhau, được xem là cơ chế đệm giúp duy trì nồng độ pH máu ổn định.
Hemoglobin kết hợp với carbon monoxide
Carbon monoxide (CO) là một loại khí độc, không màu, không mùi, không vị. Khi hemoglobin liên kết với CO sẽ tạo thành carboxyhemoglobin (HbCO), đây là một cấu trúc bền vững nhưng không có khả năng mang O2(1). CO có ái lực rất cao với hemoglobin (gấp khoảng 200 lần so với ái lực giữa O2 và hemoglobin ở người trưởng thành bình thường)(1) nên có khả năng ngăn chặn việc gắn O2 của hemoglobin, thậm chí đẩy O2 ra khỏi HbO2 khi cạnh tranh các vị trí liên kết trên heme. Do đó, khi có sự hiện diện CO, hàm lượng O2 trong máu thấp hơn nhiều so với bình thường(1).
Do CO là khí không màu, không mùi nên thường không thể phát hiện cho đến khi tiếp xúc, phơi nhiễm CO có thể gây tổn thương cho mô, hệ hô hấp hoặc tử vong. Ngộ độc khí CO là hiện tượng rất phổ biến, đặc biệt là vào mùa đông hoặc ở những nơi có khí hậu lạnh. Triệu chứng của ngộ độc khí CO phụ thuộc vào thời gian phơi nhiễm và nồng độ CO trong máu; tuy nhiên, do các triệu chứng rất đa dạng và không đặc hiệu nên dễ bị nhầm lẫn với các bệnh khác. Các triệu chứng có thể xuất hiện (nhưng không giới hạn): nhức đầu, chóng mặt, khó thở, hôn mê và tử vong.
Tài liệu tham khảo:
[1] Copstead, L. E., & Banasik, J. L. (2013). Pathophysiology. St. Louis, Mo: Elsevier.
[2] Pittman, R. N. (2016). Regulation of tissue oxygenation. San Rafael, California: Morgan & Claypool Life Sciences.
[3] Kaneko, J. J. (2008). Clinical biochemistry of domestic animals. San Diego: Academic Press.









