Tụ cầu vàng kháng methicillin: tổng quan và điều trị
1. Giới thiệu
Tụ cầu vàng (Staphylococcus aureus) là một cầu khuẩn Gram dương bất động, gây đông máu trong họ vi khuẩn có màng tế bào (Firmicutes phylum). S.aureus tìm thấy trong hệ vi sinh vật cư trú tại màng nhầy mũi ở 20 – 40% dân số nói chung. Khi hàng rào nhầy và da bị tổn thương, ví dụ như các bệnh da mạn tính, vết thương, phẫu thuật, S.aureus có thể xâm nhập vào các lớp mô dưới da hoặc máu và gây nhiễm trùng. Người bệnh có các dụng cụ y tế xâm lấn như catheter tĩnh mạch trung tâm và ngoại vi hoặc suy giảm hệ miễn dịch có nguy cơ nhiễm S.aureus [5].
Methicillin là một penicillin bán tổng hợp bảo vệ vòng betalactam không bị thuỷ phân bởi penicillinase được giới thiệu vào năm 1959, ngay sau khi được đưa vào sử dụng trên lâm sàng, tụ cầu vàng kháng methicillin (Methicillin Resistant Staphylococcus aureus – MRSA) đã được báo cáo. Sự bùng phát của MRSA xảy ra ở châu Âu vào đầu những năm 1960 [2]. Do độc tính, hiện nay methicillin không còn được sử dụng cho người và thay vào đó là các penicillin ổn định hơn như oxacillin, flucloxacillin và dicloxacillin. Dù vậy, thuật ngữ tụ cầu vàng kháng methicillin vẫn tiếp tục được sử dụng. Bên cạnh đó, MRSA còn có khả năng kháng nhiều nhóm kháng sinh khác đã trở thành vấn đề lớn [1].
MRSA khá phổ biến ở hầu hết các bệnh viện ở châu Á, tỷ lệ MRSA chiếm tới 50% các nhiễm trùng huyết do tụ cầu vàng. Tỷ lệ kháng methicillin cao liên quan đến tình trạng sử dụng kháng sinh rộng rãi cũng như tình trạng dân số đông là điều kiện thuận lợi để lan truyền nhanh các chủng đề kháng [5].
2. Cơ chế bệnh sinh
Staphylococcus aureus cư trú
S.aureus cư trú là nguyên nhân dẫn đến tình trạng nhiễm trùng ở hầu hết các trường hợp. Nhiễm trùng có thể xảy ra khi không có S.aureus cư trú trước đó như bệnh nhân có đặt Catheter hoặc vết thương không được kiểm soát tốt tình trạng nhiễm trùng. Vị trí cư trú chủ yếu của tụ cầu vàng là mũi, ngoài ra có thể gặp ở các vị trí khác như họng, đáy chậu [5].
Giai đoạn đầu của nhiễm trùng
Nhiễm trùng da và mô mềm (skin and soft tissue infections – SSTIs) do tụ cầu vàng thường bắt đầu từ sự chuyển dịch của vi khuẩn từ khoang chứa trong mũi đến các vết thương và vết xước nhỏ trên da. Tụ cầu vàng có khả năng bám dính và hình thành biofilm (là sự tích tụ dày đặc vi khuẩn trong khối cấu trúc ở ngoại bào; giúp vi khuẩn chống lại những tác động cơ học, hàng rào bảo vệ của cơ thể và liệu pháp kháng sinh) trên bề mặt nhựa hoặc bề mặt kim loại, gây nên các nhiễm trùng liên quan đến catheter, khớp nhân tạo hoặc viêm phổi thở máy. Tiếp theo đó, tụ cầu vàng lôi kéo sự xâm nhập của bạch cầu đa nhân dẫn đến hình thành tổn thương viêm tại chỗ [5].
Hình thành apxe
Protein bị kết đông bởi tụ cầu vàng có thể hình thành túi giả fibrin bao quanh vi khuẩn và các bạch cầu đa nhân, ngăn cản các bạch cầu đa nhân khác tràn vào. S.aureus có thể cản trở quá trình opsonin hóa, sản xuất ra các vi nang polysaccharide và ức chế dòng thác bổ thể [5].
Nhiễm trùng hệ thống
Áp xe có thể bị phá vỡ ở giai đoạn muộn, giải phóng dịch mủ và vi khuẩn sống theo đường da thúc đẩy quá trình lây bệnh hoặc theo đường máu gây nhiễm trùng huyết. Tụ cầu trong nội bào có thể bám dính vào bề mặt tế bào nội mô và tiểu cầu, sự kết dính này có thể gây viêm nội tâm mạc, khởi phát sự hình thành các áp xe thứ phát hoặc kích ứng sự thâm nhập của vi khuẩn vào tế bào nội mô, nơi vi khuẩn có thể tránh khỏi sự tác động của kháng sinh và các phân tử miễn dịch của cơ thể. Khả năng gây ngưng kết của các enzyme coagulase tiết ra bởi S.aureus được cho là góp phần gây nên quá trình đông máu hệ thống và sự giải phóng ồ ạt của các chất có liên quan từ vi khuẩn có dạng độc tố siêu kháng nguyên, gây ra cơn bão cytokine, dẫn đến tổn thương viêm toàn thân bùng phát, sốc nhiễm trùng và suy đa tạng nếu sự xâm nhập của vi khuẩn vào nội mạch không được kiểm soát [5].
3. Chẩn đoán vi sinh
MRSA có thể gây ra nhiều loại nhiễm trùng, như SSTIs, viêm phổi, nhiễm trùng xương khớp, hội chứng sốc nhiễm độc (là một biến chứng hiếm gặp, đe dọa tính mạng) và nhiễm trùng huyết, có thể dẫn đến viêm nội tâm mạc hoặc sốc nhiễm khuẩn.
Mẫu bệnh phẩm vi sinh liên quan đến MRSA có thể phân làm hai loại: mẫu lâm sàng và mẫu sàng lọc. Mẫu lâm sàng (ví dụ như dịch mủ, mô sâu, đờm và máu) được lấy từ người bệnh có triệu chứng hoặc dấu hiệu chẩn đoán nhiễm trùng. Mẫu sàng lọc (như phết mũi, đáy chậu và họng) được thu thập để xác định các trường hợp vi khuẩn cư trú không gây bệnh [5].
4. Điều trị nhiễm trùng
Điều trị theo kinh nghiệm
Lựa chọn kháng sinh theo kinh nghiệm điều trị nhiễm khuẩn do MRSA nên được xem xét khi bệnh nhân có một số yếu tố nguy cơ nhiễm khuẩn bệnh viện do MRSA hoặc những bệnh nhân nhiễm trùng nghi ngờ do tụ cầu nặng ở khu vực có tỷ lệ MRSA > 20%. Lựa chọn kháng sinh, đường dùng và thời gian dùng phụ thuộc vào độ nặng và vị trí nhiễm trùng. Điều trị sau đó nên điều chỉnh dựa vào kết quả nuôi cấy và kháng sinh đồ [5].
Điều trị nhiễm trùng da và mô mềm
Có thể sử dụng vancomycin, daptomycin hoặc linezolid đường tĩnh mạch cho nhiễm trùng da và mô mềm nặng. Cần tránh liệu pháp đường uống trong điều trị khởi đầu cho nhiễm trùng nặng. Clindamycin, trimethoprim–sulfamethoxazole và doxycyclin là liệu pháp thay thế cho điều trị nhiễm trùng da và mô mềm nhẹ và trung bình dựa trên kháng sinh đồ. Với áp xe da không biến chứng, sử dụng clindamycin hoặc trimethoprim–sulfamethoxazol kết hợp với rạch da và dẫn lưu giúp cải thiện tỷ lệ khỏi lâm sàng ở khoa cấp cứu và các phòng khám ngoại trú [5].
Nhiễm trùng toàn thân nặng
Các kháng sinh khuyến cáo điều trị nhiễm trùng nặng do MRSA bao gồm vancomycin hoặc daptomycin trong nhiễm khuẩn huyết, vancomycin hoặc linezolid đường tĩnh mạch cho viêm phổi mắc phải tại cộng đồng. Với nhiễm trùng nặng, không nên sử dụng linezolid đường uống cho điều trị khởi đầu. Tuy nhiên, khi bệnh nhân ổn định và có thể dung nạp thuốc đường uống, khuyến cáo chuyển sang dùng linezolid đường uống. Trong trường hợp nhiễm trùng liên quan đến dụng cụ y tế (như catheter tĩnh mạch trung tâm), để điều trị thành công thường cần thay dụng cụ nếu có thể [5].
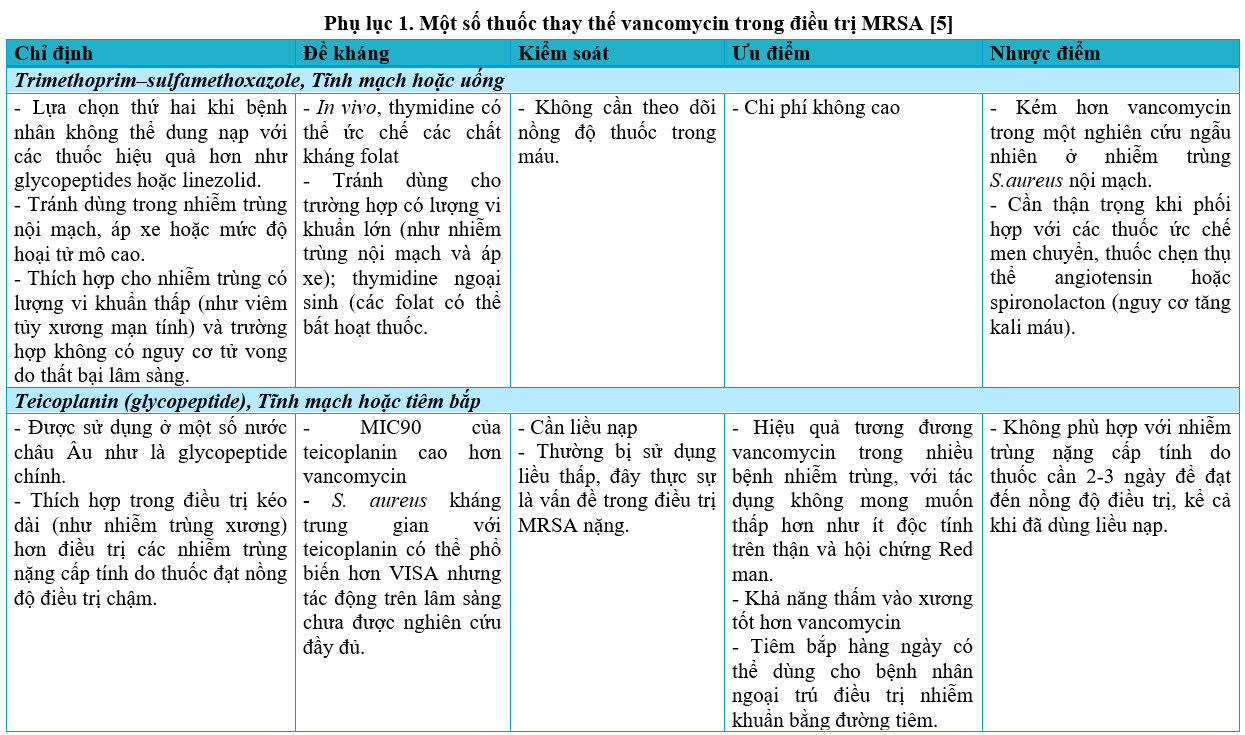
Các glycopeptid (như vancomycin, teicoplanin) là các thuốc chính trong điều trị nhiễm trùng do MRSA. Vancomycin vẫn là kháng sinh nền tảng trong điều trị nhiễm trùng nghi do MRSA theo kinh nghiệm vì đặc tính an toàn và độ hiệu quả của thuốc. Teicoplanin thường được sử dụng ở châu Âu và không thua kém vancomycin về tỉ lệ tử vong do mọi nguyên nhân, cải thiện được mức độ an toàn, tuy nhiên có ít bệnh nhân nhiễm trùng nặng được đưa vào nghiên cứu với kháng sinh này. Các glycopeptid có tốc độ diệt khuẩn chậm hơn các beta-lactam và khả năng thấm vào các mô kém [5].
Các khuyến cáo cho rằng tăng liều vancomycin để đạt nồng độ “đáy” thích hợp (nồng độ thuốc thấp nhất tại thời điểm trước khi dùng liều tiếp theo) có khả năng tối ưu tác dụng diệt khuẩn và hiệu quả trên lâm sàng. Hiệu quả diệt khuẩn thể hiện bằng kết quả nuôi cấy âm tính và cải thiện các dấu hiệu, triệu chứng của nhiễm trùng. Tối ưu hóa liệu pháp vancomycin dựa trên khả năng đạt được chỉ số AUC/MIC mục tiêu, đặc biệt với các chủng MRSA có MIC > 1 mcg/ml đang ngày càng gia tăng ở nhiều nơi được khuyến cáo. Tuy nhiên, nồng độ đáy cao có liên quan đến tăng nguy cơ độc thận và không cải thiện rõ ràng hiệu quả điều trị. Do đó, truyền tĩnh mạch liên tục vancomycin được thực hiện ở một số nước châu Âu. Với những nhiễm trùng do MRSA có MIC > 2 mcg/ml, vancomycin không còn hiệu quả, cần thay thế bằng thuốc khác. Khi MIC với vancomycin tăng cao nên cân nhắc chuyển đổi sang daptomycin sớm [5].
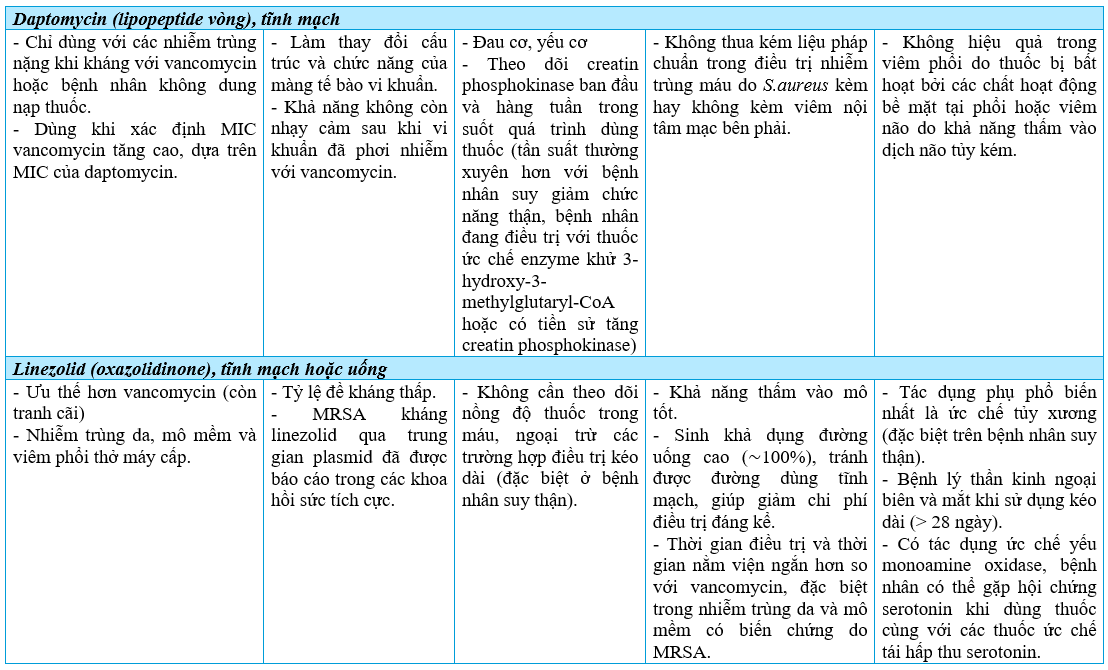
Các kháng sinh diệt MRSA khác ngày càng được sử dụng nhiều nhưng cần lưu ý về tác dụng phụ của thuốc, đặc biệt là linezolid (Phụ lục 1).
Liệu pháp kết hợp
Một thử nghiệm lâm sàng ở Hàn Quốc ở bệnh nhân viêm phổi MRSA đã chứng minh tính vượt trội của vancomycin phối hợp với rifampicin so với vancomycin dùng một mình [4]. Tuy nhiên, áp dụng phối hợp rộng rãi có thể dẫn đến gia tăng nhanh chóng đề kháng rifampicin. Hơn nữa, rifampicin có tương tác với nhiều loại thuốc thường được sử dụng ở những bệnh nhân nặng. Bằng chứng trên in vitro cho thấy tác dụng hiệp đồng kết hợp giữa beta-lactam, fluoroquinolon (như levofloxacin) và glycopeptid làm giảm tần suất vi khuẩn đột biến. Vai trò của các kết hợp kháng sinh hiệp đồng điều trị theo kinh nghiệm MRSA cần phải tiếp tục nghiên cứu trong các thử nghiệm lâm sàng [3].
Các vấn đề khác
Trái với nhiều loại nhiễm trùng khác, nhiễm tụ cầu (bao gồm cả MRSA) thường cần thời gian điều trị kéo dài do nguy cơ xảy ra các biến chứng muộn như áp xe, nhiễm trùng xương khớp. Với các nhiễm trùng huyết, thời gian điều trị tối thiểu là 14 ngày, liệu pháp ngắn hơn không được chứng minh là hiệu quả và an toàn. Các lựa chọn thay thế khác, dựa trên dữ liệu hiện có, gồm linezolid, trimethoprim–sulfamethoxazol, ceftaroline, quinupristin–dalfopristin và telavancin. Nên tránh dùng tigecyclin, do thuốc chỉ có tác dụng kìm khuẩn với MRSA và thể tích phân bố rộng với nồng độ trong mô cao nhưng nồng độ trong huyết tương thấp. Không có các dữ liệu về điều trị nhiễm trùng huyết do MRSA với các thuốc mới được công bố gần đây (như ceftobiprole, dalbavancin, oritavancin hoặc tedizolid) [5].
Tài liệu tham khảo
1. Dien Bard, J., et al., Rationale for eliminating Staphylococcus breakpoint for beta – lactam agents other than penicillin, oxacillin or cefoxitin and ceftaroline, Clin Infect Dis, 2014, 58(9): p. 1287-96.
2. Enright, M.C., et al., The evolutionary history of methicillin-resistant Staphylococcus aureus (MRSA), Proc Natl Acad Sci USA, 2002, 99 (11): p.7687-92.
3. Cao, B., et al., Consensus statement on the management of methicillin-resistant Staphylococcus aureus nosocomial pneumonia in Asia, Clin Respir J, 2015, 9(2): p.129-42.
4. Jung, Y.J., et al., Effect of vancomycin plus rifampicin in the treatment of nosocomial methicillin-resistant Staphylococcus aureus pneumonia, Crit Care Med, 2010, 38(1): p.175-80.
5. Andie S. Lee., et al., Methicillin-resistant Staphylococcus aureus, Nat Rev Dis Primers, 2018, 4:18033.









