️ Trị liệu miễn dịch công nghệ gen (P1)
MỞ ĐẦU
Ý tưởng khai thác hệ miễn dịch để điều trị ung thư – trị liệu miễn dịch (cancer Immunotherapy) đã nảy sinh cách đây ít nhất một thế kỷ. Trị liệu miễn dịch nói chung nếu phân loại theo chức năng thì gồm 2 thể loại:
Trị liệu miễn dịch thụ động - đưa các yếu tố biểu hiện của hệ miễn dịch (các kháng thể phản ứng khối u, các cytokin kháng u hoặc các TB hiệu ứng diệt ung thư) tới bệnh nhân với mục đích là để các tác nhân này tấn công trực tiếp các TB ung thư.
Trị liệu miễn dịch chủ động (bao hàm các vaccin kháng u và các cytokin kích thích miễn dịch) nhằm kích thích hệ miễn dịch kháng u một cách hiệu quả. Cả trị liệu miễn dịch chủ động và thụ động đều là những bộ phận không thể tách rời của thực hành y học hiện đại với các vấn đề đa dạng như điều trị rắn cắn và phòng ngừa các bệnh truyền nhiễm.
Nhưng đối với ung thư thì vai trò của hệ miễn dịch và trị liệu miễn dịch đã là một chủ đề tranh cãi suốt 50 năm qua, trọng điểm tranh cãi là liệu các TB khối u sinh miễn dịch trong túc chủ của chúng là gốc rễ của vấn đề hay là hệ miễn dịch có khả năng kiểm soát hoặc loại trừ các TB ác tính.
Hiện tại, lý lẽ có vẻ ngả theo hướng có lợi cho trị liệu miễn dịch ung thư, một phần là do người ta am hiểu hơn về sinh học khối u cũng như đã phát động được các cơ chế điều hòa miễn dịch kháng u hiệu quả.
Nếu các TB ung thư dễ bị kiểm soát bởi hệ miễn dịch thì sự thành công của miễn dịch trị liệu ung thư chỉ đơn giản là vấn đề về sự né tránh của khối u khỏi sự kiểm soát miễn dịch.
Người gây được uy tín trong thử nghiệm trị liệu miễn dịch chủ động đầu tiên là Coley. Ngay từ cuối thế kỷ 19 đầu thế kỷ 20 ông đã tiêm vi khuẩn chết vào các khối u. Sau đó lại thử nghiệm tiêm vào khối u các tác nhân khác gây cảm ứng đáp ứng viêm (như các chủng BCG của Mycobacterium bovis hoặc các virus), hoặc tiêm chủng cho bệnh nhân ung thư các chế phẩm của tế bào khối u toàn phần. Mặc dầu một số bệnh nhân biểu lộ có hiệu ứng với trị liệu miễn dịch sớm, nhưng thắng lợi tổng thể thì dường như là chưa có.
Nhờ sự phát triển của công nghệ lai tế bào B và kháng thể đơn dòng vào những năm 1970, các bệnh nhân đã được xử lý bằng trị liệu miễn dịch thụ động với các kháng thể đơn dòng của chuột đã làm tinh khiết để phản ứng với các kháng nguyên ung thư xác định. Cùng thời gian trên, lymphokin interleukin 2 (IL-2) kích thích miễn dịch cũng đã được phân dòng và dẫn đến các thử nghiệm lâm sàng trị liệu miễn dịch với cytokin tái tổ hợp. Công nghệ DNA tái tổ hợp nhanh chóng tiến tới các thử nghiệm về các cytokin khác có khả năng thúc đẩy các hoạt tính miễn dịch kháng u hoặc làm trung gian cho các hiệu ứng kháng u trực tiếp. Công nghệ này cũng dẫn đến việc sản xuất ra các protein kháng nguyên khối u tái tổ hợp cho các vaccin đặc hiệu kháng u.
Mặc dù sự ngụy biện cho các chiến lược trị liệu miễn dịch trên cơ sở điều hành các protein tái tổ hợp ngày càng gia tăng, nhưng những thành công được đánh giá là kiểm soát được khối u thì tương đối hiếm. Quan trọng hơn là việc sử dụng một số cytokin tái tổ hợp trong các TNLS thường đi kèm với các độc tính rất nguy hiểm thậm chí đe dọa tới sinh mạng con người.
Gen trị liệu có tiềm năng đề xuất các phương thức trị liệu miễn dịch vừa hiệu quả hơn lại ít nguy hiểm hơn. Việc điều phối các protein trị liệu mã hóa cho các gen có thể duy trì được mức protein “tự nhiên” hơn in vivo, giảm thiểu các vấn đề liên quan tới cytokin vừa có độc tố với nồng độ cao mà lại có đời sống bán phần ngắn. Trị liệu miễn dịch công nghệ gen cũng phải khắc phục vấn đề là cần sản xuất và làm tinh khiết một lượng lớn các protein tái tổ hợp – một quá trình có thể gây cản trở cho việc khởi đầu các thử nghiệm trên người. Đối với các vaccin kháng u thì sự chuyển giao bằng công nghệ gen cũng có thể nhận dạng được miễn dịch kháng nguyên làm lợi hơn cho sự khởi đầu đáp ứng miễn dịch kháng u.
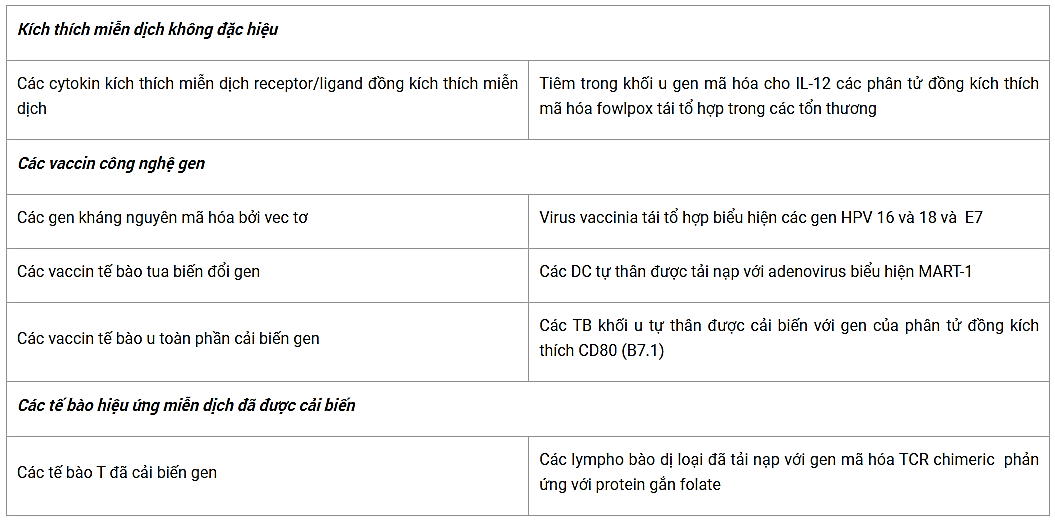
Đây là những lý do làm cho gen trị liệu được đón chào nhiệt liệt trong việc phát triển các chiến lược trị liệu miễn dịch hiện nay. Trong chương này chúng tôi sẽ đề cập một cách tổng quan về hệ miễn dịch liên quan với ung thư và sau đó giới thiệu ngắn gọn các phương pháp trị liệu miễn dịch công nghệ gen đã được khảo sát trên các mô hình động vật cũng như các thử nghiệm trên người cho tới thời điểm này. Trên Bảng 1 trình bày các ví dụ về trị liệu miễn dịch công nghệ gen của các thử nghiệm lâm sàng trên người hiện thời.
Bảng 8.1. Các ví dụ về các thử nghiệm lâm sàng sử dụng trị liệu miễn dịch công nghệ gen trên các bệnh nhân ung thư
MIỄN DỊCH HỌC KHỐI U
Các cơ chế hiệu ứng miễn dịch
Đáp ứng miễn dịch về nguyên tắc được phân thành 2 con đường cơ bản: miễn dịch bẩm sinh và miễn dịch thu được. Một cách đơn giản là, các đáp ứng miễn dịch thu được là kết quả từ sự “rèn luyện” (education) kháng nguyên của hệ thống miễn dịch, trong khi đó thì các đáp ứng bẩm sinh được hiểu là “được thừa hưởng” (inherited). Trong đáp ứng miễn dịch bẩm sinh, hoạt tính hiệu ứng được phát ra thông qua việc gắn kết của các receptor được mã hóa bởi các gen dòng mầm. Các đáp ứng miễn dịch thu được phụ thuộc vào sự đa dạng của các receptor có thể biến đổi, được biểu hiện bởi các tế bào T hoặc B, chúng được lắp ráp bởi tái tổ hợp soma của các yếu tố gen dòng mầm. Đáp ứng miễn dịch bẩm sinh có thể được hình dung như là một cơ chế bảo vệ miễn dịch tiền tiêu được phát triển theo dẫn liệu của các kháng nguyên nghi ngờ, trong khi đó miễn dịch thu được là một đáp ứng muộn do gặp gỡ kháng nguyên đặc hiệu. Các đáp ứng miễn dịch cả trong miễn dịch bẩm sinh cũng như miễn dịch thu được đều liên quan tới kiểm soát miễn dịch ung thư. Bảng 8.2 dưới đây liệt kê các hiệu ứng có liên quan tới miễn dịch khối u.
Bảng 8.2. Các hiệu ứng của các đáp ứng miễn dịch kháng u

Miễn dịch bẩm sinh
Đáp ứng miễn dịch bẩm sinh gây tranh cãi liên quan đến hiệu quả miễn dịch kháng u trong suốt thời gian dài. Các tế bào giết tự nhiên (NK) được mô tả đầu tiên là các TB giống như TB lympho làm trung gian giết một số TB khối u với phương thức không bị giới hạn bởi MHC (tức là các receptor tế bào T kinh điển không có liên quan tới độc tế bào). Các tế bào NK nuôi cấy được xử lý với cytokin kích thích miễn dịch IL-2 (các TB giết được hoạt hóa bởi lymphokin – lymphokin activated killer cell - LAK) sẽ sản sinh ra các TB hiệu ứng ly giải TB có khả năng giết nhiều TB khối u với phương thức không bị giới hạn bởi MHC.
Có ít nhất 3 loại TB lympho T đã được phân loại có khả năng giết các TB khối u không bị giới hạn bởi MHC trong các hệ thống thực nghiệm, đó là các tế bào NK không biểu hiện TCR; các tế bào NKT (natural killer T cell) biểu hiện giới hạn αβTCR và các tế bào γδ-TCR lympho tương đối hiếm. Mỗi hiệu ứng lympho đều có thể được phân biệt bởi kiểu hình trên bề mặt tế bào, các cơ chế nhận dạng và giết TB khối u và kiểu hình đích TB khối u cho dễ bị tấn công. Hơn nữa, đối với hoạt tính ly giải khối u bẩm sinh qua trung gian tương tác tế bào – tế bào thì những hiệu ứng miễn dịch bẩm sinh của lympho có thể tác động tới sự tăng trưởng của khối u bằng cách tiết ta các cytokin (chẳng hạn như interferon –γ) để ức chế trực tiếp sự tăng sinh TB ung thư hoặc điều chỉnh MHC của tế bào khối u và biểu hiện kháng nguyên để tăng cường các đáp ứng miễn dịch thu được.
Các TB miễn dịch dòng tủy, các bạch cầu đơn nhân/đại thực bào và bạch cầu trung tính/bạch cầu hạt cũng được nghiên cứu lâu dài với tư cách là các trung gian kiểm soát và giết các TB khối u. Cả 2 dạng TB hiệu ứng này đều biểu hiện các receptor của IgG và có khả năng làm trung gian cho độc tế bào phụ thuộc kháng thể kháng lại các TB khối u opsonin hóa với các kháng thể. Tuy nhiên, một số thí nghiệm đã chỉ rõ rằng các tế bào hiệu ứng dòng tủy này cũng có thể làm trung gian cho hoạt tính kiềm chế kháng u “bẩm sinh”, hoặc các cơ chế ly giải TB phụ thuộc tiếp xúc tế bào - tế bào hoặc tiết ra các yếu tố kiềm chế khối u. Mặt khác lại có bằng chứng là các đại thực bào liên kết khối u có thể kiềm chế sự phát triển của các đáp ứng miễn dịch thu được kháng u.
Như đã đề cập ở trên, một khía cạnh của đáp ứng miễn dịch bẩm sinh đối với khối u là sự cảm ứng của các cytokin kiềm chế khối u. Chẳng hạn như các interferon (inteferon (INF) typ I (IFN-α và IFN-β) và typ II (IFN-γ) có thể ức chế trực tiếp sự tăng trưởng của các TB khối u trong các mô hình thực nghiệm, và việc trị liệu bằng interferon đặc hiệu đã được FDA phê chuẩn để chữa các bệnh ác tính (Roferon, Intron). Nhưng có lẽ điều quan trọng hơn là sự cảm ứng của các cytokin và chemokine đã thúc đẩy hoạt hóa các đáp ứng miễn dịch thu được đối với khối u.
Miễn dịch thu được
Các đáp ứng miễn dịch thu được phụ thuộc vào các receptor kháng nguyên tế bào αβT và tế bào B (αβ-TCR và BCR). Các TCR và BCR được sản sinh bởi sự tái tổ hợp soma của nhiều thành phần gen dòng mầm (V,D,J,C). Tính đa dạng của đặc hiệu KN được tạo nên bởi nhiều yếu tố gen tại vùng biến đổi có khả năng tái tổ hợp, bởi các đột biến soma và sự thoái hóa khu vực kết nối tạo nên các trình tự receptor độc quyền bổ sung.
Đáp ứng miễn dịch thu được thiết lập bởi sự lựa chọn dòng điều khiển bởi KN của các tế bào biểu hiện các receptor có ái lực thích ứng với KN cùng với các tín hiệu đồng kích thích thứ cấp cần thiết và thường bởi việc sản sinh ra các tế bào B hoặc T nhớ miễn dịch.
BCR là một dạng liên kết màng của kháng thể tiết, nó là binh chủng hiệu ứng đáp ứng miễn dịch thu được của tế bào B. Các kháng thể có thể làm trung gian cho ít nhất 3 dạng hoạt tính hiệu ứng kháng lại các tế bào khối u. Sự ly giải tế bào phụ thuộc bổ thể (CDC) là do sự hoạt hóa thác bổ thể bởi kháng thể gắn trên bề mặt tế bào đích. Vai trò của CDC trong miễn dịch khối u vẫn còn nhiều tranh cãi. Tuy nhiên, các CDC khối u đã được chứng minh bằng thực nghiệm in vitro. Trên thực tế in vivo thì CDC ít hiệu quả và hầu hết các TB (tế bào khối u) biểu hiện các thể điều hòa màng của bổ thể lại ức chế sự ly giải bổ thể một cách hiệu quả. Sự ly giải tế bào qua trung gian tế bào phụ thuộc kháng thể lại được trung gian bởi các tế bào hiệu ứng miễn dịch biểu hiện các receptor cho phần Fc của IgG (FcγR), bao gồm các tế bào NK, đại thực bào/bạch cầu đơn nhân và bạch cầu hạt. Các kháng thể của các kháng nguyên tế bào khối u xác định cũng có thể làm trung gian trực tiếp cho các hiệu ứng kháng u khi vắng mặt bổ thể hoặc các tế bào hiệu ứng FcγR. Điều đó đã chứng minh rằng các kháng thể đặc hiệu cho các receptor xác định có liên quan tới tăng trưởng, tăng sinh hay sự sống sót của TB, bao gồm receptor họ yếu tố tăng trưởng bì Her2/neu/erbB2 có biểu hiện ở một số u đặc và phân tử CD20 biểu hiện nhiều ở u lympho tế bào B.
Αβ-TCR tham dự vào nhiều con đường đáp ứng miễn dịch thu được. Các tế bào CD4+ T- trợ giúp nhận dạng các KN peptid hiện diện trong các phân tử MHC lớp II, rất quan trọng đối với việc khuếch đại và điều hòa các đáp ứng miễn dịch đặc hiệu KN được khởi đầu bởi các tế bào trình diện KN. Bản chất của đáp ứng tế bào T - trợ giúp là điều chỉnh một cách tương đối đáp ứng của các tế bào B (sản xuất kháng thể) và tế bào lympho T độc tế bào (CTL) đối với một kháng nguyên đã cho. Các CTL kinh điển là các tế bào T CD8+, CD3+ nhận dạng các peptid kháng nguyên trong MHC lớp I. Các tế bào khối u thường biểu hiện MHC lớp I chứ không phải là MHC lớp II. Tuy nhiên, sự tham dự của các tế bào T – trợ giúp nhận dạng MHC lớp II thích ứng có thể là cần thiết để tạo nên một đáp ứng kháng u CTL mạnh mẽ.
Sự cân bằng giữa trình diện MHC lớp I và lớp II đối với các tế bào αβ – T chỉ đạo phần nào sự cân bằng giữa đáp ứng kháng thể và đáp ứng CTL đối với một kháng nguyên đã cho. Vấn đề này bị ảnh hưởng bởi phương thức tương tác của tế bào T hoặc B với tế bào trình diện KN (APC). Với các APC mà kháng nguyên được biểu hiện nội sinh (như các tế bào khối u biểu hiện các kháng nguyên của chúng) thì ưa trình diện peptid MHC lớp I, đến lượt mình nó lại thúc đẩy sự hoạt hóa các CTL đặc hiệu kháng nguyên. Các APC mà kháng nguyên được hấp thu ngoại sinh (như sự thực bào của đại thực bào) thì ưa trình diện peptid MHC lớp II, đến lượt mình lại hoạt hóa các tế bào T CD4+ đặc hiệu kháng nguyên thúc đẩy đáp ứng kháng thể tế bào B đặc hiệu kháng nguyên, các CTL hoặc thậm chí cả tế bào T kiềm chế miễn dịch.
Kết quả cuối cùng của BCR hoặc αβ –TCR nhận dạng kháng nguyên phụ thuộc một phần vào các kích thích phụ trợ, bao gồm các cytokin, các phân tử đồng kích thích APC và các tế bào B hoặc T đáp ứng. Thực nghiệm cũng cần phải làm rõ các chiến lược tiêm chủng kháng nguyên khối u làm thúc đẩy các đáp ứng kháng thể tế bào B có gây tổn hại tới các đáp ứng CTL hay không và ngược lại.
Các tế bào tua (Dendritic Cell)
Năm 1973, Steinman và cộng sự lần đầu tiên công bố loại tế bào miễn dịch được phát hiện mới, với tên gọi là dendritic cell (DC), tên gọi này bắt nguồn từ hình dạng của các tế bào (dạng hình tua và sao). Việc phân loại các tế bào này thường dựa vào vị trí hiện diện của chúng trong cơ thể, vào hình thức trình diện kháng nguyên và quá trình trưởng thành của chúng. Từ lúc được khám phá đến nay, nhóm tế bào này đã thể hiện tiềm năng ứng dụng to lớn trong lĩnh vực y học. Nhiều nghiên cứu lâm sàng đã chứng minh khả năng điều trị hiệu quả bệnh ung thư, các bệnh truyền nhiễm của nhóm tế bào này.
Đây là nhóm tế bào miễn dịch, ngoài chức năng chủ yếu là trình diện kháng nguyên, chúng còn đóng vai trò quan trọng trong kiểm soát quá trình đáp ứng miễn dịch bẩm sinh và thu được. Do có khả năng xử lý và trình diện kháng nguyên cho các tế bào miễn dịch nên DC được xếp vào nhóm tế bào trình diện kháng nguyên APC (Antigen Processing Cell).
Với một lượng lớn các loại receptor dùng để nhận biết và thu nhận kháng nguyên trên bề mặt tế bào của mình như các receptor mannose (MRC 1/CD 206), DC – SIGN/CD 209, langerni/CD 207,…nên DC có khả năng tiếp nhận, trình diện nhiều loại kháng nguyên khác nhau như kháng nguyên tế bào ung thư, kháng nguyên virus, vi khuẩn tới nhiều loại tế bào khác nhau như tế bào lympho T, lympho B và tế bào NK (Natural Killer).
Ngoài chức năng trình diện kháng nguyên, DC còn đóng vai trò quan trọng trong kiểm soát và điều hoà đáp ứng miễn dịch của cơ thể. Thông qua việc tiết cytokin, các DC chưa trưởng thành và trưởng thành có thể ức chế hoặc tăng cường đáp ứng miễn dịch của cơ thể.
Tế bào DC có thể được bắt gặp nhiều nơi trong cơ thể như vùng biểu mô, hạch lympho và trong máu. Các dòng tế bào DC khác nhau có chung nguồn gốc là tế bào gốc tạo máu, quá trình biệt hoá của DC từ tế bào gốc tạo máu diễn ra tại nhiều nơi trong cơ thể. Các tế bào tiền thân DC có thể gặp trong máu ngoại vi, các tế bào này trải qua quá trình biệt hóa để thành tế bào DC chưa trưởng thành và trưởng thành dưới sự kích hoạt của GM-CSF, IL 4 và nhiều cytokin khác. Do vậy, DC trưởng thành có thể được thu nhận từ các tế bào đơn nhân trong máu, tế bào gốc tạo máu dưới sự cảm ứng của các cytokin thích ứng.
Nói tóm lại, DC là các tác nhân điều hòa tiềm năng cả cho đáp ứng miễn dịch bẩm sinh cũng như miễn dịch thu được. Cũng có các bằng chứng cho thấy, những tế bào này có thể trực tiếp tham gia vào việc cảm ứng dung nạp miễn dịch, điều đó không có lợi cho trị liệu miễn dịch ung thư nhưng lại có lợi cho việc trị liệu các hội chứng tự miễn hay dị ứng.
Xem thêm: Trị liệu miễn dịch công nghệ gen (P2)
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









