️ Vai trò của LH trong kích thích buồng trứng
Tuyến yên bài tiết ra hai hormon hướng sinh dục là FSH (Follicle-stimulating hormone) và LH (Luteinizing hormone), trong đó FSH có tác dụng kích thích nang noãn phát triển còn LH có tác dụng làm noãn trưởng thành và phóng noãn. Tuy vậy trong quá trình phát triển nang noãn, LH cũng đóng vai trò rất quan trọng. Trong phạm vi bài này bằng cách tham khảo các tài liệu trong nước cũng như quốc tế với mong muốn cập nhật một số kiến thức về vai trò của LH và kinh nghiệm của các tác giả trên thế giới về ứng dụng của LH trong các phác đồ kích thích buồng trứng điều trị bệnh nhân vô sinh.
Từ khóa: LH, kích thích buồng trứng
SUMMARY
Pituitary gland secretes two sex hormones, FSH (Follicle-stimulating hormone) và LH (Luteinizing hormone), in which FSH stimulates follicular development while LH make follicles mature and ovulation. However, LH also plays a very important role in the development of follicles. Within the scope of this article by referring to domestic and international medical literature with the desire to update some knowledge about the role of LH and the experience of international authors on the application of LH in the ovarian stimulation protocols for treatment of infertile patients.
Key words: LH, ovarian stimulation
I. ĐẶT VẤN ĐỀ
Từ trước đến nay khi nói đến kích thích buồng trứng điều trị vô sinh chúng ta thường nghĩ tới việc sử dụng chất cạnh tranh với receptor E2 vùng dưới đồi (clomiphen citrat) hoặc sử dụng trực tiếp FSH để kích thích buồng trứng mà ít khi đề cập tới LH. Tuy nhiên nghiên cứu trên thực nghiệm cũng như các phác đồ kích thích buồng trứng trong thụ tinh trong ống nghiệm cho thấy LH cũng đóng vai trò quan trọng trong sự phát triển nang noãn và trong các phác đồ kích thích buồng trứng.
Trong phạm vi bài này chúng tôi tập trung tìm hiểu các giả thuyết và các nghiên cứu của các giả trên thế giới để chứng minh vai trò cần thiết của LH trong sự phát triển và trưởng thành nang noãn, từ đó giúp các bác sỹ hiểu rõ hơn cơ chế và quá trình sinh lý trong kích thích buồng trứng.
II. NỘI DUNG
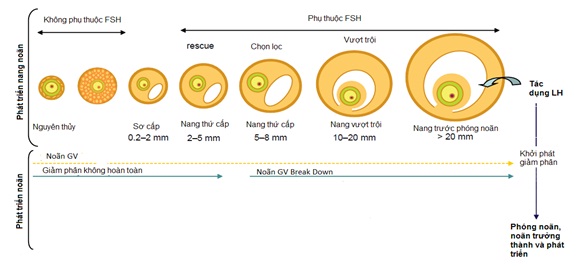
2.1. Sự phát triển nang noãn và vai trò của hormon Gonadotropin trong sự phát triển nang noãn
Các nang noãn phát triển trong gồm hai giai đoạn là giai đoạn không phụ thuộc hormon, kéo dài từ trước chu kỳ kinh khoảng 3 tháng. Cho đến nay vẫn chưa rõ cơ chế phát triển các nang noãn trong giai đoạn này, rất có thể việc tuyển chọn nang phát triển phụ thuộc vào yếu tố nội tại của buồng trứng mà đến nay chưa được sáng tỏ. Vào đầu chu kỳ kinh, các nang noãn đã được tuyển chọn từ ba tháng trước (nang thứ cấp) sẽ tiếp tục phát triển dưới tác dụng của hormon FSH.
Nang sơ cấp (pre-antral follicle)
Đầu chu kỳ kinh, nồng độ FSH tăng dần làm cho một nhóm các nang noãn phát triển bước vào giai đoạn nang sơ cấp, nang noãn trong giai đoạn này có kích thước khoảng 200mm, có nhiều tế bào hạt bao xung quanh. Số lượng receptor trên bề mặt các tế bào hạt tăng lên khoảng 1500 receptor/tế bào. Thời điểm này tế bào hạt bắt đầu sản xuất 17 b-estradiol bằng cách thơm hoá androgen do tế bào vỏ sản xuất ra dưới tác dụng của LH (giả thuyết hai hormon hướng sinh dục, hai tế bào). Estradiol và FSH làm phát triển tế bào hạt và tăng số lượng receptor trên màng tế bào hạt. Dịch nang bắt đầu hình thành và tích tụ lại trong nang.
Nang thứ cấp (antral follicle)
Nang thứ cấp có kích thước khoảng 500mm. Vào ngày thứ 5 đến thứ 7 của chu kỳ kinh chỉ có các nang trội mới có thể tiếp tục phát triển vì các nang này mới có khả năng chuyển androgen thành estrogen, các nang còn lại sẽ bị thoái hoá đi. Nang trội tiếp tục phát triển, bài tiết estradiol và inhibin B có tác dụng gây ức chế tuyến yên bài tiết FSH. FSH làm xuất hiện các receptor LH trên bề mặt tế bào hạt. Nồng độ estradiol tăng dần sẽ kích thích tuyến yên bài tiết đỉnh LH, đỉnh LH xuất hiện sau khi nồng độ E2 đạt đỉnh 12-14 giờ. Người ta đã phát hiện ra ít nhất 33 chất điều hoà sự phát triển và thoái triển của nang noãn, đó là các peptid của buồng trứng trong đó phải kể đến là các chất Insulin-Like Growth factor I (IGF-I) làm tăng quá trình thơm hoá, kích thích tế bào hạt phân bào, làm tăng số lượng receptor LH. Inhibin ức chế sản xuất FSH, Activin…
Nang noãn trước phóng noãn (preovulate follicle)
Nang noãn trước phóng noãn căng tròn, chứa dịch nang, noãn gắn vào thành nang noãn bởi cuống là các tế bào hạt gọi là gò noãn (oophoros cumulus). Trên siêu âm đầu dò tần số cao có thể thấy được gò noãn trước phóng noãn 36 giờ. Nồng độ estrogen tăng cao làm tăng bài tiết LH. Đỉnh LH làm cho nang noãn hoàng thể hoá và kích thích tế bào hạt sản xuất ra progesterone. LH kích thích sản xuất cytokin trong đó chất được biết đến nhiều nhất là Interlekin-1 (IL-1) có tác dụng khởi phát prostaglandin và proteolytic (men tiêu protein) làm cho nang noãn vỡ ra. Phóng noãn xảy ra khoảng 34-36 giờ sau đỉnh LH, khi nang noãn đạt kích thước trung bình 20 mm, noãn trong nang noãn giải phóng ra di chuyển theo vòi tử cung về buồng tử cung. Sau phóng noãn các tế bào nang còn lại thành hoàng thể tiếp tục sản xuất ra estradiol, progesterone và inhibin, các chất này ức chế sự phát triển của các nang khác. Cuối giai đoạn hoàng thể, nếu không có hCG hoàng thể sẽ bị teo đi làm cho nồng độ các hormon buồng trứng tụt xuống làm bong niêm mạc tử cung, và tạo điều kiện cho hormon FSH tăng dần bắt đầu một chu kỳ buồng trứng mới.
2.2. Hormone lh có vai trò gì trong trưởng thành noãn và giả thuyết hai hormon hai tế bào
Trong chu kỳ phát triển nang noãn, LH được bài tiết ngay từ đầu chu kỳ với nồng độ thấp và tăng dần cho đến giữa chu kỳ đạt nồng độ cao nhất (đỉnh LH) có tác dụng làm trưởng thành noãn [17]. Gougeon (1986) cho rằng trưởng thành noãn không chỉ diễn ra trong pha nang noãn mà quá trình này là giai đoạn cuối cùng của cả một quá trình kéo dài từ khoảng 1 năm trước đó. Trong suốt một năm đó, sự phát triển và trưởng của nang noãn chịu tác động của sự thay đổi các hormon tuyến yên lặp đi lặp lại qua nhiều chu kỳ [13].
Tuy nhiên, nếu nồng độ LH quá cao sẽ có tác dụng không tốt đến kết quả có thai, ví dụ trên các bệnh nhân bị hội chứng buồng trứng đa nang. Ở các bệnh nhân này có rối loạn phóng noãn, buồng trứng nhiều nang nhỏ mà không có nang nào vượt trội lên, nồng độ LH cao biểu hiện bằng tỷ lệ LH/FSH > 2. Nghiên cứu của Homburg và cộng sự (1993) đã chỉ ra tỷ lệ sảy thai trên các bệnh nhân buồng trứng đa nang cao hơn so với các bệnh nhân vô sinh vì các nguyên nhân khác [16]. Chính vì vậy khi kích thích buồng trứng bằng phác đồ dài cho các bệnh nhân buồng trứng đa nang có thể cải thiện tỷ lệ có thai do agonist sẽ ức chế tuyến yên giảm bài tiết LH.Hormon FSH và LH của tuyến yên có vai trò khác nhau trên sự phát triển và trưởng thành noãn. Ryan và Petro (1966) đưa ra giả thuyết hai hormon, hai tế bào, LH kích thích các tế bào vỏ nang bài tiết androgen, androgen thấm vào các tế bào hạt, và dưới tác dụng của FSH, androgen trong tế bào hạt sẽ được thơm hóa để chuyển thành estrogen. Chính vì vậy nếu thiếu LH sẽ giảm quá trình thơm hóa nên không chuyển androgen thành estrogen được, kết quả làm giảm nồng độ estrogen trong dịch nang cũng như trong huyết thanh. Chính vì vậy cả FSH và LH đều rất cần cho quá trình phát triển và trưởng thành nang noãn.
Ngoài ra theo Glueck thì các bệnh nhân hội chứng buồng trứng đa nang có nồng độ LH cao là biểu hiện của hiện tượng kháng Insulin, đây cũng là nguyên nhân gây sảy thai. Do vậy sử dụng các thuốc làm tăng nhạy cảm của tế bào với insulin trên các bệnh nhân này có thể đạt được kết quả có thai tốt hơn so với chỉ dùng chất đồng vận GnRH đơn thuần [12].
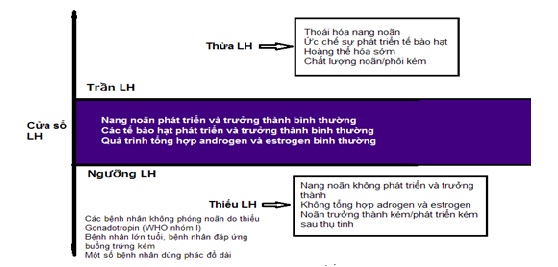
2.3. Khái niệm “cửa sổ” LH, “ngưỡng” và “trần” LH
Howles và cộng sự nghiên cứu dùng clomiphen citrat và hMG kích thích buồng trứng nhận thấy ở các bệnh nhân có nồng độ LH cao thường đi kèm chất lượng noãn và phôi kém. Tác giả cho rằng có “cửa sổ” nồng độ LH mà nếu LH nằm trong khoảng cửa sổ này sẽ đảm bảo cho nang noãn phát triển bình thường; nếu nồng độ LH vượt quá mức này thì nang noãn có thể bị thoái hóa hoặc bị hoàng thể hóa sớm [18].
Hillier (1994), Shoham (2003), Balasch và Fabregues (2002) nghiên cứu trên thực nghiệm đã kết luận nồng độ LH cao có thể gây thoái hóa các nang noãn, đặc biệt là các nang nhỏ, tác giả gọi đó là “trần” LH. Nếu nồng độ LH vượt qua trần này sẽ ảnh hưởng xấu đến kết quả kích thích buồng trứng [14, 23, 1].
2.4 Sử dụng LH kích thích buồng trứng cho các bệnh nhân suy vùng dưới đồi tuyến yên.
Từ các giả thuyết và nghiên cứu trên chúng ta biết rõ là LH rất cần cho sự phát triển và trưởng thành nang noãn, để nang noãn phát triển và trưởng thành thì nồng độ LH phải vượt qua một ngưỡng nhất định. Điều này rất rõ khi kích thích buồng trứng cho bệnh nhân suy vùng dưới đồi tuyến yên bắt buộc phải sử dụng cả FSH và LH. Các bệnh nhân này do thiếu cả hai loại hormon tuyến yên FSH và LH nên buồng trứng không hoạt động, bị teo nhỏ, các nang noãn không phát triển và bệnh nhân không có kinh. Nếu như trước đây các bệnh nhân này được kích thích buồng trứng bằng hMG chiết xuất từ nước tiểu phụ nữ mãn kinh có chứa cả FSH và LH với tỷ lệ 75 đv FSH/75 đv LH thì sau này với sự ra đời của hormon tuyến yên tinh chế cao và gần đây là hormon sản xuất bằng công nghệ tái tổ hợp gen có chứa rất ít hoặc không có LH nên khi kích thích buồng trứng bắt buộc phải bổ sung thêm LH vào phác đồ cùng với FSH.
Balash và cộng sự (1995) báo cáo trường hợp bệnh nhân bị suy vùng dưới đồi tuyến yên được điều trị thụ tinh trong ống nghiệm trong ba chu kỳ với ba phác đồ kích thích buồng trứng khác nhau. Chu kỳ dùng thứ nhất sử dụng r-FSH đơn thuần, chu kỳ thứ hai dùng FSH tinh chế cao kết hợp với estradiol valerate và chu kỳ thứ ba dùng hMG. Trong chu kỳ dùng r-FSH nang noãn phát triển bình thường nhưng nồng độ estradiol rất thấp, chọc hút có noãn nhưng tỷ lệ thụ tinh chỉ là 28%. Tác giả cho rằng tỷ lệ thụ tinh thấp có thể do nồng độ estradiol thấp nên trong chu kỳ thứ hai đã cho thêm estradiol valerate. Tuy nhiên khi tác giả kích thích buồng trứng bằng FSH tinh chế cao kết hợp với estradiol valerate cũng không cải thiện được tỷ lệ thụ tinh. Trong chu kỳ thứ 3 dùng hMG (có cả FSH và LH) thì nang noãn phát triển bình thường, nồng độ estradiol bình thường và tỷ lệ thụ tinh là 93%. Điều này chỉ giải thích là các bệnh nhân bị suy vùng dưới đồi tuyến yên khi kích thích buồng trứng cần có cả LH và FSH [2].
Nghiên cứu trên 38 bệnh nhân suy tuyến yên kích thích buồng trứng bằng rFSH đơn thuần liều 150đv/ngày hoặc cho thêm rLH với liều 25đv, 75đv và 225đv/ngày, khi nang noãn đạt kích thước 17 mm thì tiến hành tiêm 10.000đv hCG. Kết quả nhóm bệnh nhân dùng thêm rLH liều 75đv và 225đv/ngày chọc hút được nhiều noãn hơn nhóm không dùng và nhóm dùng rLH liều 25đv/ngày [7]. Mặc dù số lượng bệnh nhân chưa đủ lớn để có thể khẳng định liều LH tối thiểu phải dùng là 75đv nhưng cũng có thể khẳng định nồng độ LH phải vượt qua một ngưỡng nhất định để nang noãn phát triển và trưởng thành.
2.5. Sử dụng LH trên các bệnh nhân kích thích buồng trứng bằng phác đồ dài
Các bệnh nhân kích thích buồng trứng bằng phác đồ dài trong thụ tinh trong ống nghiệm phải trải qua hai pha trong đó pha đầu tiên là pha ức chế tuyến yên. Agonist ức chế tuyến yên dùng trong thời gian trung bình từ 12 đến 14 ngày. Các chỉ số để đánh giá tuyến yên đã bị ức chế hoàn toàn khi nồng độ E2 < 100 đv và LH < 5 đv. Tuy nhiên cũng có những trường hợp bị ức chế quá mức dẫn đến chỉ số LH thấp dưới mức bình thường (LH < 1 đv). Trong các trường hợp này cần thiết phải bổ sung thêm LH trong pha kích thích buồng trứng.
Fleming (1996) nghiên cứu trên 60 bệnh nhân kích thích buồng trứng bằng hMG hoặc FSH tinh khiết cao sử dụng phác đồ dài [9]. Kết quả cho thấy nồng độ testosteron và estradiol trong dịch nang thấp hơn ở nhóm bệnh nhân có nồng độ LH < 1,0. Điều này chứng tỏ khi thiếu LH ở các bệnh nhân dùng phác đồ dài sẽ làm giảm tổng hợp androgen và estrogen, có nghĩa là giảm sự phát triển và trưởng thành nang noãn.
Tuy nhiên, rất có thể có một ngưỡng LH nào đó mà dưới ngưỡng đó thì cần bù thêm để phác đồ kích thích đạt kết quả tốt. Câu hỏi được đặt ra là ngưỡng LH là bao nhiêu?
Humaidain và cộng sự (2002) nghiên cứu tiến cứu trên 207 bệnh nhân kích thích buồng trứng theo phác đồ dài sử dụng r-FSH. Bệnh nhân được phân nhóm dựa vào nồng độ LH vào ngày 8, gồm 4 nhóm với nồng độ LH < 0,5 đv/l, LH từ 0,51 – 1,0đv/l, LH từ 1,01 – 1,5 đv/l và LH > 1,5đv/l. Kết quả có thai cao nhất ở nhóm bệnh nhân có nồng độ LH ngày 8 từ 0,5-1,5 đv/l. Nhóm bệnh nhân có nồng độ LH > 1,5 thì tỷ lệ có thai thấp hơn nhóm bình thường thậm chí còn thấp hơn so nhóm có nồng độ LH < 0,5đv/l [19].
Nếu nồng độ LH thấp hơn ngưỡng thì kết quả kích thích buồng trứng sẽ kém. Gần đây một số tác giả còn quan tâm tỷ lệ FSH/LH liên quan với kết quả có thai. Ho và cộng sự (2005) báo cáo tỷ lệ FSH/LH > 3 vào ngày đầu tiên kích thích buồng trứng sau khi ức chế tuyến yên bằng GnRH agonist thì kết quả có thai cũng không cao [15]. Theo Filicori (1999) thì nồng độ LH quá cao sẽ ảnh hưởng đến tế bào hạt trong nang noãn, mà điều này rất cần thiết cho việc duy trì sự phát triển nang noãn trong giai đoạn cuối của kỳ giảm phân cho đến khi phóng noãn [8]. Nồng độ LH cao cũng dẫn đến tăng nồng độ androgen, kết quả làm ảnh hưởng đến trưởng thành nang và noãn [6]. Tác động của nồng độ LH cao rất rõ ràng trong các chu kỳ kích thích buồng trứng trong các chu kỳ kích thích bằng phác đồ ngắn. Phân tích hồi cứu 240 chu kỳ điều trị, Lui và cộng sự chỉ ra rằng trong các chu kỳ kích thích buồng trứng bằng phác đồ ngắn mà nồng độ LH > 5 đv/l vào ngày 8 thì tỷ lệ làm tổ cũng thấp hơn [20].
Trên invitro, khi cho thêm r-LH và r-FSH vào môi trường nuôi cấy sẽ làm cải thiện phân chia gián phân đầu tiên cho đến giai đoạn metaphase của noãn [4] do LH đã tạo ra điều kiện thích hợp cho việc phân bào của noãn [3].
2.6. Bổ sung LH vào phác đồ kích thích buồng trứng tùy từng bệnh nhân
Từ khi r-LH được tổng hợp (Luveris), rất nhiều nghiên cứu bổ sung LH vào phác đồ dài agonist và phác đồ antagonist để xem LH có tác dụng không. Marrs nhận thấy bổ sung LH cho các bệnh nhân trên 35 tuổi có thể thu được nhiều nang noãn hơn, tăng tỷ lệ làm tổ cũng như tỷ lệ có thai [21]. Hơn nữa lợi ích của việc bổ sung LH cũng được xác định ngay cả khi sử dụng vào ngày thứ 6 hoặc thứ 8. Điều này dường như giống như sinh lý là các tế bào hạt thông qua FSH thì chỉ cần recepter LH một khi khi nang noãn đạt ít nhất là 11 mm [22]. Từ bàn luận trên các tác giả đã nghiên cứu hai nhóm bệnh nhân, một nhóm các bệnh nhân suy vùng dưới đồi tuyến yên, và một nhóm bệnh nhân suy sinh dục nhân tạo gồm các bệnh nhân dùng GnRH agonist tác dụng chậm trong phác đồ dài. Các bệnh nhân lớn tuổi trong nghiên cứu này đều cần phải bổ sung LH và cho kết quả tốt.
Cơ chế nào mà khi bổ sung LH lại cải thiện được tác dụng kích thích buồng trứng? Foong và cộng sự nghiên cứu kích thích buồng trứng bằng FSH cho các bệnh nhân đáp ứng kém, nhận thấy mặc dù nồng độ E2 huyết thanh tương tự các bệnh nhân đáp ứng bình thường nhưng nồng độ E2 trong dịch nang thấp hơn và nồng độ progesterone cao hơn ở các bệnh nhân đáp ứng kém [10]. Trên invitro đã chứng minh E2 đóng vai trò quan trọng trong việc trưởng thành bào tương noãn, làm tăng tỷ lệ thụ tinh và tỷ lệ phân chia phôi. Tóm lại LH có tác dụng tốt thông qua cơ chế cải thiện trưởng thành noãn thông qua E2 hoặc một vài yếu tố nội tại của buồng trứng [24].
Placido và cộng sự nghiên cứu tiến cứu ngẫu nhiên bệnh nhân đáp ứng bình thường bằng phác đồ dài dùng GnRH tác dụng kéo dài. Tác giả ghi nhận có 10 – 15% bệnh nhân đáp ứng kém với FSH vào ngày 8, các bệnh nhân này được xác định đáp ứng kém khi E2 < 180 pg/ml và siêu âm không có nang trên 10 mm. Các bệnh nhân đáp ứng kém này được phân ngẫu nhiên vào nhóm dùng 75 đv/ngày r-LH (n-23) hoặc 150đv/ngày r-LH (n=23). Các bệnh nhân đáp ứng bình thường được xếp vào nhóm chứng (n=46). Tác giả đã báo cáo tăng đáng kể số nang noãn trong nhóm dùng liều LH 150 đv, số lượng noãn tương đương nhóm chứng [5].
Khi kích thích buồng trứng có thể bổ sung LH theo hai cách khác nhau là bổ sung hMG hoặc bổ sung r-LH (Luveris) trong đó có chứa 75 đv LH. Trong hMG chứa hCG dưới dạng 75 đv LH (Giudice và cs 2001). Thậm chí các sản phẩm Menopur hoặc Menogon (Ferring Arzneimittel AG, Kiel, Germany) cũng có chứa hCG [11]. Thời gian bán huỷ của hCG dài hơn LH 3 lần, và ái lực với receptor LH cao hơn do vậy có thể làm tăng tác dụng của LH và dẫn tới tăng tích luỹ LH làm vượt nồng độ LH quá trần gây phản tác dụng. Ngược lại nếu dùng r-LH cho phép điều chỉnh liều theo từng bệnh nhân.
III. KẾT LUẬN
Quá trình phát triển và trường thành nang noãn cần thiết có cả hai loại hormon là LH và FSH mặc dù lượng LH cần rất thấp. Trong quá trình kích thích buồng trứng trên một số bệnh nhân nồng độ LH trong huyết thanh giảm dưới ngưỡng bình thường do đó cần phải bổ sung LH ngoại sinh bằng r-LH. Các bệnh nhân này bao gồm các trường hợp dùng phác đồ dài ức chế quá mức LH (đặc biệt là ức chế tuyến yên bằng GnRH tác dụng kéo dài), bệnh nhân lớn tuổi, các bệnh nhân đáp ứng kém và bệnh nhân bị suy vùng dưới đồi tuyến yên.
Đối các bệnh nhân suy vùng dưới đồi tuyến yên, khi kích thích buồng trứng cần phải dùng cả hai loại hormon FSH và LH vì các bệnh nhân này thiếu hụt cả hai loại hormon này.
TÀI LIỆU THAM KHẢO
- Balasch J, Fábregues F (2002). Is luteinizing hormone needed for optimal ovulation induction? Curr Opin Obstet Gynecol. 14(3):265-74.
- Balash, J, Miro, F, Burzac , et al (1995). The role of luteinizing hormone in human follicle development and oocyte fertility: evidence from in-vitro fertilization in a woman with long standing hypogonadotropic hypogonadism and using recombinant human follicle stimulating hormon. Hum Reprod 10, 1678-1683.
- Balasch J,Creus M, Fábregues F, et al (2001). The effect of exogenous luteinizing hormone (LH) on oocyte viability: evidence from a comparative study using recombinant human follicle-stimulating hormone (FSH) alone or in combination with recombinant LH for ovarian stimulation in pituitary-suppressed women undergoing assisted reproduction. J Assist Reprod Genet. 18(5):250-6.
- Cortvrindt R, Hu Y, Smitz J (1998). Recombinant luteinizing hormone as a survival and differentiation factor increases oocyte maturation in recombinant follicle stimulating hormone supplemented mouse preantral follicle culture. Hum Reprod. 13(5):1292-302.
- De Placido G,Alviggi C, Mollo A, et al (2004). Effects of recombinant LH (rLH) supplementation during controlled ovarian hyperstimulation (COH) in normogonadotrophic women with an initial inadequate response to recombinant FSH (rFSH) after pituitary downregulation. Clin Endocrinol. 60(5):637-43.
- Erickson Erickson GF,Magoffin DA, Dyer CA, et al (1985). The ovarian androgen producing cells: a review of structure/function relationships. Endocr Rev. 6(3):371-99.
- Europen Recombinant Human LH Study Group (1998). Recombinant human luteinizing hormone (LH) to support recombinant human follicle-stimulating hormone (FSH)-induced follicular development in LH- and FSH-deficient anovulatory women: a dose-finding study. J Clin Endocrinol Metab. 83(5):1507-14.
- Filicori, M (1999). The role of luteinizing hormone in folliculogenesis and ovulation induction. Fertil Steril. 71(3):405-14.
- Fleming R, Chung CC, Yates RW, et al (1996). Purified urinary follicle stimulating hormone induces different hormone profiles compared with menotrophins, dependent upon the route of administration and endogenous luteinizing hormone activity. Hum Reprod. 11(9):1854-8.
- Foong SC,Abbott DH, Lesnick TG, et al (2005). Diminished intrafollicular estradiol levels in in vitro fertilization cycles from women with reduced ovarian response to recombinant human follicle-stimulating hormone. Fertil Steril. 83(5):1377-83.
- GiudiceE, Crisci C, Altarocca V, et al (2001). Characterisation of a partially purified humanmenopausal gonadotropin preparation. J Clin Res 4: 27-33.
- Glueck, C.J, Phillips, H., Cameron, D., et al (2001). Continuing metformin throughout pregnancy in women with polycystic ovary syndrome appears to safety reduce first-trimester spontaneous abortion: a pilot study. Ferti Steril 75, 46-52.
- Gougeon, A (1986). Dynamics of follicular growth in human: a model from preliminary results. Hum Reprod 1, 81-87.
- Hillier, SG (1994). Current concept of the role of follicle stimulating hormon and luteinizing hormon in folliculogenesis. Hum Reprod 9, 188-191.
- Ho JY, Guu HF, Yi YC, et al (2005). The serum follicle-stimulating hormone-to-luteinizing hormone ratio at the start of stimulation with gonadotropins after pituitary down-regulation is inversely correlated with a mature oocyte yield and can predict “low responders” Fertil Steril.83(4):883-8.
- Homburg, R, Levy T, Berkovitz D, et al (1993). Gonadotropin-releasing hormone agonist reduces the miscarriage rate for pregnancies achieved in women with polycystic ovarian syndrome. Fertil Steril.59(3):527-31
- Howeles, C.M (2000). Role of LH and FSH in ovarian function. Mol Cell Endocrinol 161, 25-30.
- Howles,C.M, Macnamee, MC(1990). The endocrinology of stimulated cycles and influence on outcome. In Mashiach. Et al (eds), Advances in Assissted Reproductive Technologies. Plenum Press, New York, pp 311-325.
- Humaidain, P, Bungum, L, Bungum M, et al (2002). Ovarian response and pregnancy outcome related to mid-follicular LH levels in women undergoing assissted reproduction with GnRH agonist down regulation and recombinant FSH stimulation. Hum Repro 17, 2016-2021
- Lui SY,Han JL, Peng XD, et al (2005). Effect of midfollicular luteinizing hormone levels on ovarian response and pregnancy outcome in patients undergoing in vitro fertilization in a short-term protocol. Fertil Steril. 83(4):1043-6.
- Marrs R,Meldrum D, Muasher S, et al (2004). Randomized trial to compare the effect of recombinant human FSH (follitropin alfa) with or without recombinant human LH in women undergoing assisted reproduction treatment. Reprod Biomed Online. 8(2):175-82.
- Richards JS,Jahnsen T, Hedin L, et al (1987). Ovarian follicular development: from physiology to molecular biology. Recent Prog Horm Res. 43:231-76.
- Shoham Z (2003). Treatment of female infertility with recombinant human luteinising hormone: is there a benefit over other available drugs? Expert Opin Pharmacother.4(11):1985-94.
- Tesarik J, Mendoza C, (1995). Nongenomic effects of 17 beta estradiol on maturing human oocytes: relationship to oocyte developmental potential. J Clin Endocrinol Metab. 80(4):1438-43.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh