️ Nguyên nhân gây u và liên hệ lâm sàng (P2)
CƠ SỞ PHÂN TỬ CỦA QUÁ TRÌNH SINH UNG (CARCINOGENESIS):
Mấu chốt của quá trình sinh ung là các đột biến gen không gây chết xảy ra trên 4 loại gen sau:
Tiền-oncogen (proto-oncogene)
Gen ức chế u (tumor suppressor gene)
Gen điều hoà sự tự hủy tế bào (apoptosis)
Gen sửa chữa ADN
Các đột biến gen không gây chết này xảy ra là do tác động của các yếu tố môi trường (virút, hoá học, bức xạ), do bố mẹ truyền cho (thí dụ gen gây u nguyên bào võng mạc) hoặc có tính tự phát.
Tiền-oncogen:
Trong điều kiện sinh lý bình thường, sự tăng sinh tế bào được kiểm soát rất chặt chẽ, một tế bào muốn hoạt động tăng sinh thì phải qua các bước sau (Hình 42):
Có yếu tố tăng trưởng đặc hiệu.
Gắn kết yếu tố tăng trưởng lên thụ thể tương ứng có trên bề mặt tế bào; sự gắn kết này phát ra tín hiệu tăng sinh cho tế bào.
Tín hiệu được chuyển từ màng tế bào vào trong nhân nhờ vào hoạt động của các protein truyền tín hiệu có trên màng tế bào và trong bào tương.
Gen mã hoá cho protein điều hoà sao chép được hoạt hoá, protein điều hoà sao chép được tổng hợp, đi vào trong nhân kích thích sự tổng hợp ADN làm tế bào phân chia.
Các tiền-oncogen giữ vai trò quan trọng đối với sự tăng sinh tế bào; bởi vì chúng mã hoá các protein cần thiết cho tất cả các bước trên như các yếu tố tăng trưởng, protein truyền tín hiệu, protein điều hoà sao chép trong nhân.
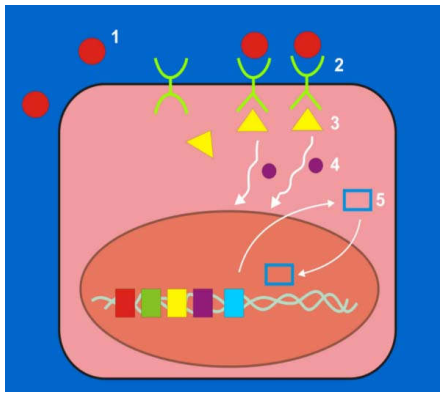
Hình 42: Các bước kiểm soat sự tăng sinh tế bào: Yếu tố tăng trưởng (1), thụ thể tương ứng (2), protein truyền tín hiệu ở mặt trong màng tế bào (3) và tự do trong bào tương (4), protein điều hòa sao chép (5)
Chính vì vậy, khi cấu trúc của tiền-oncogen bị thay đổi do các đột biến hoặc khi sự biểu hiện của nó bị rối loạn, tiền-oncogen được hoạt hoá thành oncogen-tế bào (c-onc), có khả năng kích thích tế bào chuyển dạng tăng sinh một cách quá mức và tự động, thoát khỏi mọi cơ chế kiểm soát bình thường trong cơ thể.
Bảng sau đây giới thiệu 1 số trong hơn 100 tiền-oncogen đã được biết cho đến nay và các loại u có thể xuất hiện khi các tiền-oncogen này được hoạt hóa thành oncogen- tế bào:
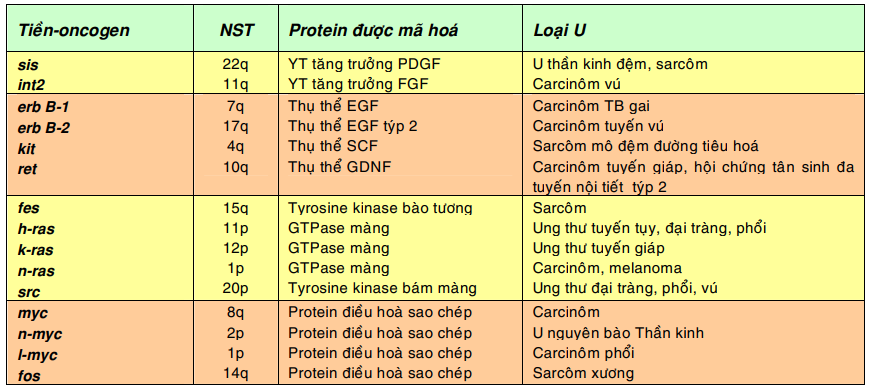
Chú thích: PDGF, yếu tố tăng trưởng xuất phát từ tiểu cầu (platelet derived growth factor); FGF, yếu tố tăng trưởng nguyên bào sợi (fibroblast growth factor); EGF, yếu tố tăng trưởng biểu bì (epidermal growth factor); SCF, yếu tố tế bào gốc (Stem cell factor); GDNF, yếu tố hướng thần kinh xuất phát từ dòng tế bào thần kinh đệm ( Glial cell line derived neutrotrophic factor)
Các oncogen được xem là những gen ung thư trội (dominant cancer gene) bởi vì chỉ cần một trong 2 tiền-oncogen alen với nhau bị hoạt hoá thành oncogen là đủ để có tác động sinh u. Thí dụ (hình 43):
Khi 1 trong 2 tiền-oncogen sis (simian sarcoma) bị hoạt hoá thành oncogen c-sis, sản phẩm bình thường của nó là yếu tố tăng trưởng PDGF sẽ được sản xuất quá mức, có khả năng kích thích tế bào tăng sinh tạo thành u; thí dụ như u sao bào, sarcôm xương.
Tiền-oncogen erb B-1 ( avian erythroblastosis) mã hoá cho protein thụ thể đối với yếu tố tăng trưởng biểu bì EGF (epidermal growth factor), khi bị hoạt hoá thành oncogen c-erb-1 sẽ khiến protein thụ thể này được sản xuất quá mức, kết quả tế bào tăng sinh mạnh dù chỉ có ít yếu tố tăng trưởng tác động. Ghi nhận có sự hoạt động của oncogen này trong 80% các trường hợp carcinôm tế bào gai ở phổi. Tương tự như vậy, khoảng 30% các trường hợp carcinôm tuyến vú di căn, có sự hoạt hoá tiền oncogen erb B-2 thành oncogen c-erb-2 (còn gọi là oncogen Her-2/neu).
Tiền-oncogen ras (rat sarcoma) mã hoá cho 1 protein truyền tín hiệu tăng sinh nằm ở mặt trong màng tế bào. Các đột biến điểm xảy ra trên tiền-oncogen ras sẽ biến nó thành oncogen c-ras có khả năng kích thích tế bào tăng sinh tạo thành u, dù không có yếu tố tăng trưởng tác động. Ghi nhận có sự hoạt động của oncogen này trong khoảng 30% các ung thư ở người.
Tiền-oncogen myc (myelocytomatosis), mã hoá cho 1 protein điều hoà sao chép trong nhân. Các chuyển đoạn nhiễm sắc thể, khuyếch đại gen có thể biến tiền-oncogen myc thành oncogen c-myc; kết quả protein điều hoà trên được sản xuất quá mức, kích thích tế bào tăng sinh tạo thành các ung thư như limphôm Burkitt, ung thư phổi loại tế bào nhỏ.
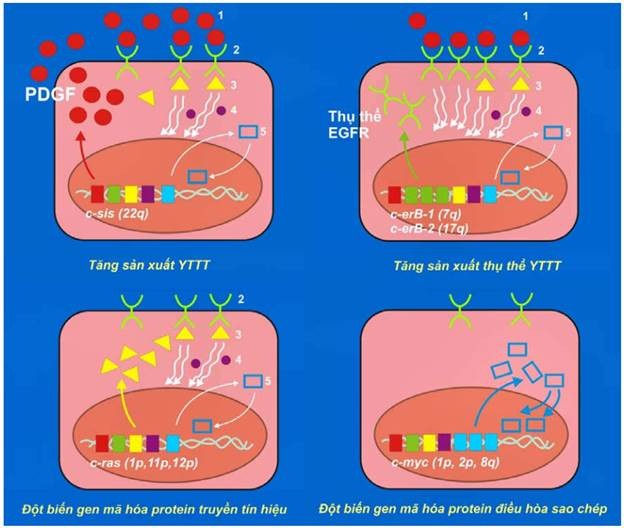
Hình 43: Sơ đồ hoạt hóa các tiền oncogen thành oncogen tế bào, tác động sinh u.
Gen ức chế u (tumor suppressor gene):
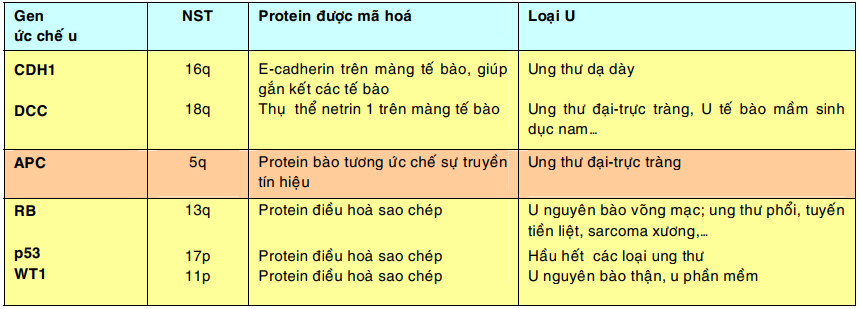
Các gen ức chế u giữ vai trò kìm hãm sự tăng sinh tế bào; chúng mã hoá cho các yếu tố ức chế tăng trưởng, các phân tử điều hoà sự kết dính giữa các tế bào, phân tử truyền tín hiệu ức chế và các phân tử điều hoà sao chép trong nhân. Các đột biến gây thiếu hụt hoặc bất hoạt các gen này có thể dẫn đến sự hình thành u do sự tăng sinh tế bào không còn bị kìm hãm nữa. Vì cả 2 gen ức chế u alen với nhau phải cùng bị thiếu hụt hoặc bất hoạt thì mới có tác động sinh u nên chúng còn được gọi là các gen ung thư lặn (recessive cancer gene).
Bảng sau đây giới thiệu 1 số trong hơn 30 gen ức chế u đã được biết cho đến nay:
Gen Rb: là gen ức chế u đầu tiên được phát hiện, nằm trên nhiễm sắc thể 13. Khi cả 2 gen Rb bị bất hoạt sẽ dẫn đến sự hình thành u nguyên bào võng mạc, một loại ung thư trẻ em hiếm gặp. Trong nhiều loại ung thư của người lớn như ung thư phổi, ung thư vú và ung thư ruột già, cũng thấy có sự bất hoạt cả 2 gen Rb.
Gen Rb mã hoá cho protein Rb (pRb). Bình thường khi tế bào nghỉ ngơi ở giai đoạn G0 hoặc G1, pRb ở dạng không bị phosphoryl hoá, có khả năng ức chế các protein điều hoà sao chép làm cho sự tăng sinh của tế bào bị kìm hãm. Trái lại, khi tế bào nhận được tín hiệu tăng sinh, pRb được phosphoryl hoá sẽ không còn ức chế các protein điều hoà sao chép, các tế bào đi vào phân chia. Như vậy, khi cả 2 gen Rb bị thiếu hụt hoặc khi pRb bị bất hoạt, protein điều hoà sao chép không bị ức chế sẽ khiến tế bào tăng sinh tự do, dẫn đến sự hình thành u (Hình 44).
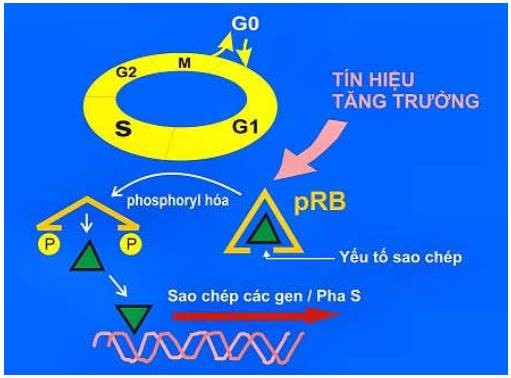
Hình 44: Cơ chế tác động của gen Rb
Ở đây cần giải thích vì sao u nguyên bào võng mạc-thể di truyền được xem là 1 ung thư di truyền trội nhiễm sắc thể thường trong khi đó gen Rb lại là gen ung thư lặn: Trong thể bệnh di truyền này, trẻ sinh ra đã nhận được 1 gen Rb bị bất hoạt từ bố hoặc mẹ, gen alen Rb còn lại vẫn bình thường nên tất cả các tế bào soma trong cơ thể trẻ đều ở tình trạng dị hợp tử về gen Rb lành. Các tế bào võng mạc của trẻ ban đầu vẫn bình thường vì chỉ cần có 1 gen Rb lành cũng đủ đảm bảo chức năng kìm hãm sự tăng sinh tế bào. Tuy nhiên, tình trạng dị hợp tử về gen Rb lành của tế bào võng mạc dễ bị mất đi do 1 đột biến mới làm bất hoạt gen Rb lành còn lại (Loss of heterozygosity), khiến sự tăng sinh của tế bào này không còn kiểm soát được, dẫn đến u nguyên bào võng mạc. Trái lại, trong u nguyên bào võng mạc - thể lẻ tẻ, trẻ sinh ra nhận đủ 2 gen Rb lành từ bố mẹ; vì thế để tạo được u thì phải có 1 tế bào võng mạc chịu 2 lần đột biến liên tiếp để bất hoạt cả 2 gen alen Rb (mô hình 2 cú đánh của Knudson); điều này ít khả năng xảy ra hơn so với chỉ 1 lần đột biến trong thể di truyền. Như vậy, gen Rb là 1 gen ung thư lặn, nhưng trong u nguyên bào võng mạc-thể di truyền thì "tình trạng dị hợp tử làm dễ bị u nguyên bào võng mạc" đã được truyền theo kiểu trội - nhiễm sắc thể thường. (Hình 45)
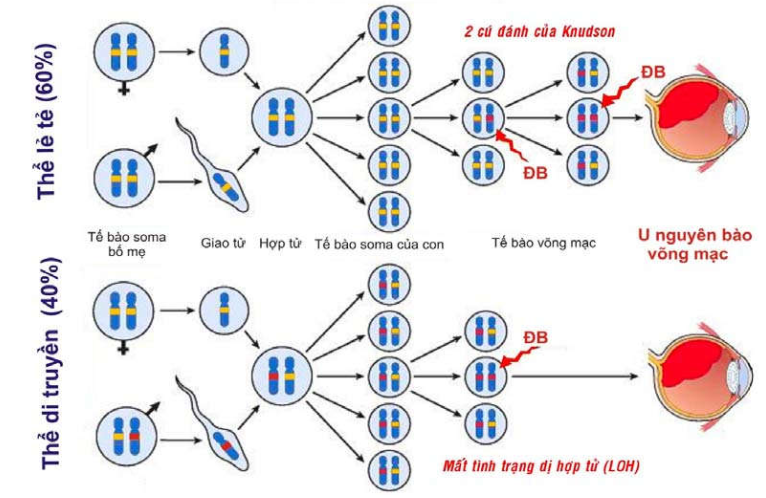
Hình 45 : Mô hình 2 cú đánh của Knudson trong cơ chế phát sinh u nguyên bào võng mạc
Gen p53: là một gen ức chế u khác nằm trên nhiễm sắc thể 17. Người ta ghi nhận có sự bất hoạt cả 2 gen alen p53 trong hầu hết các loại ung thư ở người.
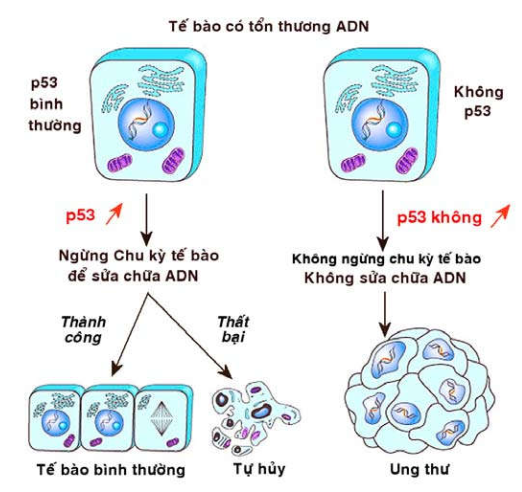
Hình 46: Cơ chế tác động của gen p53
Khác với gen Rb, hoạt động kìm hãm của gen p53 chỉ xảy ra khi ADN của tế bào bị tổn thương (một cách tự phát hoặc do tác động của các yếu tố môi trường). Khi đó, hàm lượng protein p53 trong nhân tăng lên nhanh chóng, giúp tế bào ngừng lại ở giai đoạn G1 để có thời gian sửa chữa các tổn thương trên ADN. Nếu sửa chữa thành công, tế bào tiếp tục đi vào giai đoạn S và hoạt động tăng sinh bình thường; trường hợp thất bại, protein p53 sẽ làm tăng sản xuất protein Bax và Bak, đồng thời ức chế bcl-2; kết quả là tế bào bị thúc đẩy đi vào quá trình tự hủy. Như vậy, khi cả 2 gen p53 đều bị đột biến bất hoạt (do nhiễm HPV, EBV, HBV), các tế bào dù đang bị tổn thương ADN vẫn tiếp tục tăng sinh và có thể dẫn đến ung thư (Hình 46)
Gen sửa chữa ADN:
Các tổn thương ADN vẫn thường xuyên xảy ra trong quá trình hoạt động của tế bào, một cách tự phát hoặc do tác động của các yếu tố môi trường. Tuy nhiên phần lớn các tổn thương này đều được sửa chữa kịp thời nhờ vào hoạt động của các gen sửa chữa ADN sẵn có như gen MSH2, MLH1, PMS1, PMS2 v.v... Do đó khi các gen này bị thiếu hụt hay bất hoạt thì sẽ làm tăng nguy cơ xuất hiện ung thư (Hình 47).
Thí dụ: Trong bệnh khô bì sắc tố, có sự khiếm khuyết về các gen sửa chữa ADN vì vậy các tổn thương ADN do bức xạ cực tím gây ra không được sửa chữa kịp thời, bệnh nhân dễ bị ung thư da hơn người bình thường.
Các gen điều hoà sự tự hủy tế bào (apoptosis):
Gồm 2 nhóm gen có tác động trái ngược nhau:
Gen thúc đẩy sự tự hủy tế bào, thí dụ như các gen bad, bax, bak, bim, bid, bik, bok,...
Gen ức chế sự tự hủy tế bào, thí dụ gen Bcl-2, Bcl-XL, Bcl-X,...
Các đột biến gây thiếu hụt nhóm gen thứ nhất hoặc làm tăng biểu hiện của nhóm gen thứ hai sẽ khiến các tế bào dù có tổn thương ADN vẫn không tự hủy, tiếp tục sống sót và tăng sinh, dẫn đến sự hình thành ung thư (Hình 47).
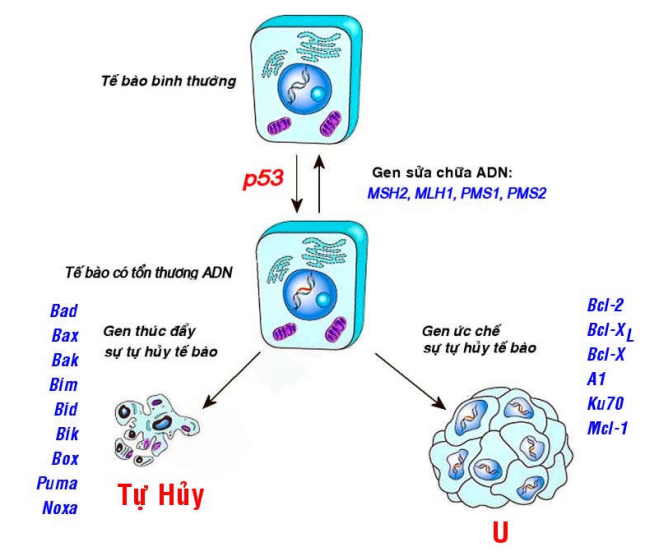
Hình 47: Hoạt động của các gen sửa chữa ADN và các gen điều hòa sự tự hủy tế bào
Tóm lại, quá trình phát triển tự nhiên của ung thư gồm 4 bước nối tiếp nhau là chuyển dạng ác tính, tăng trưởng u, xâm nhập và di căn. Xét về mặt phân tử, diễn tiến tuần tự từng bước này tương ứng với sự tích lũy các đột biến (xuất hiện tự phát hoặc do tác động của môi trường) làm hoạt hoá các tiền-oncogen, bất hoạt các gen ức chế u, gen điều hòa sự tự hủy tế bào và gen sửa chữa ADN. Trong sự hình thành mỗi loại ung thư ở người, ước lượng phải có từ 3 đến 7 đột biến như vậy.
Thí dụ trong carcinôm tuyến đại tràng; người ta cho rằng tổn thương bắt đầu bằng sự chuyển dạng và tăng sinh tế bào biểu mô tuyến tạo thành 1 u tuyến lành tính; u tuyến này lớn dần và sau cùng hoá ác, xâm nhập tại chỗ qua các lớp thành ruột và cho di căn. Diễn tiến này tương ứng với sự bất hoạt trước tiên các gen ức chế u APC và gen sửa chữa ADN MSH2, tiếp theo là sự hoạt hoá tiền-oncogen ras, rồi đến các đột biến làm thiếu hụt các gen ức chế u khác như DCC, p53 và thêm nhiều gen khác nữa (Hình 48).
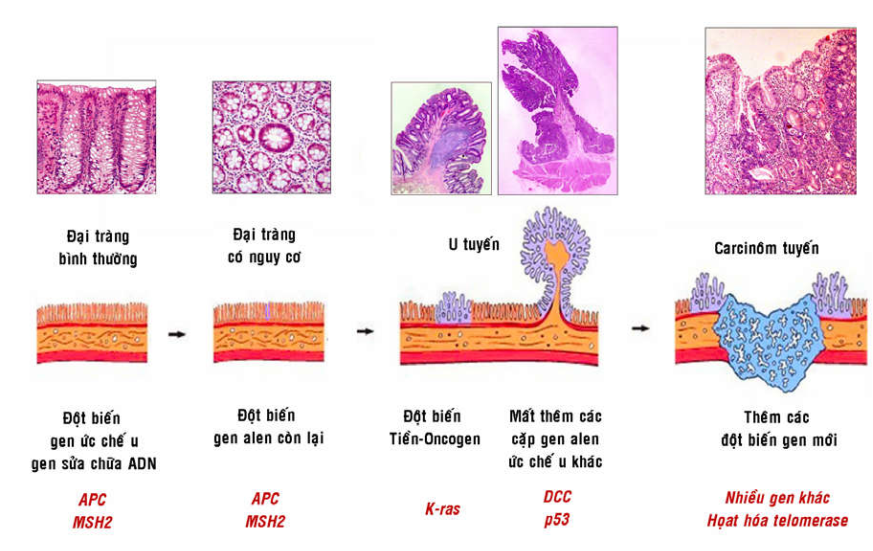
Hình 48: Sự tích lũy đột biến trong quá trình hình thành carcinôm tuyến đại tràng.
LIÊN HỆ LÂM SÀNG:
Tác động của u trên cơ thể:
Mọi khối u đều là những vật ký sinh trên cơ thể, có thể gây ra những tác động từ nhẹ đến nặng, tùy vào vị trí xuất hiện và tính chất lành hoặc ác của chúng.
Tại chỗ:
Sự phát triển của khối u sẽ chèn ép và cản trở hoạt động của các mô - cơ quan lân cận, vì vậy có thể gây nguy hiểm nếu u xuất hiện ở những vị trí quan trọng, cho dù đó là 1 u lành tính.
Thí dụ:
Một u tuyến yên lành tính có kích thước nhỏ, đường kính 1 cm, vẫn có thể chèn ép phá hủy mô tuyến bình thường xung quanh, dẫn đến tình trạng suy tuyến yên. Các u não, dù lành hoặc ác đều nguy hiểm tính mạng do khả năng làm tăng áp lực nội sọ, chèn ép lên các cấu trúc quan trọng của hệ thần kinh trung ương.
U thành ruột, dù lành tính, vẫn có thể dẫn đến lồng ruột và tắc ruột.
Các u lành có tính di động, như u nang buồng trứng, polýp đại tràng; có thể bị xoắn lại gây xuất huyết, hoại tử.
Toàn thân:
Tác động nội tiết: xảy ra đối với những u xuất phát từ tuyến nội tiết, thí dụ:
U vỏ thượng thận, lành hoặc ác, có thể gây ra hội chứng Cushing do tế bào u sản xuất quá nhiều corticosteroid.
U tế bào bêta tuyến tụy có thể gây hạ đường huyết do sản xuất quá nhiều insulin.
Suy mòn: là tình trạng biến mất dần khối cơ - mỡ trong cơ thể, hay gặp ở các bệnh nhân ung thư. Tình trạng suy mòn đuợc giải thích là do sự thay đổi về vị giác, mất cảm giác thèm ăn hoặc do tác động của một số cytokin lưu hành trong máu.
Hội chứng cận ung thư (Paraneoplastic syndrome):
Là các phức hợp triệu chứng xảy ra ở các bệnh nhân ung thư ( khoảng 10% số bệnh nhân ung thư) mà không thể giải thích được bằng sự xâm nhập tại chỗ hoặc di căn xa của khối u, hoặc bằng hoạt động sản xuất các hormôn vốn có ở mô nguyên ủy của khối u.
Các hội chứng cận ung thư thường gặp là hội chứng Cushing, sự tăng canxi máu, huyết khối tĩnh mạch. Các loại ung thư thường có hội chứng cận ung thư là ung thư phổi, ung thư vú và ung thư hệ tạo huyết. Thí dụ:
Trong ung thư phổi loại tế bào nhỏ, có thể gặp hội chứng Cushing và tăng canxi máu do tế bào u có khả năng sản xuất ra ACTH và các péptid tương tự hormôn tuyến cận giáp.
Hạ đường huyết có thể gặp ở bệnh nhân bị sarcôm sợi, u mô đệm đường tiêu hóa; do tế bào u sản xuất được insulin hoặc chất tương tự insulin.
Huyết tắc tĩnh mạch có thể gặp ở ung thư phổi, ung thư tuyến tụy, do tế bào u sản xuất các chất hoạt hoá hệ thống đông máu.
Xếp giai đoạn ung thư (Staging of cancer):
Nhằm đánh giá mức độ lan tràn của ung thư, làm cơ sở cho việc xác định phác đồ điều trị hợp lý, đánh giá tiên lượng, so sánh hiệu quả của các phương pháp điều trị khác nhau hoặc giữa các cơ sở điều trị. Để xếp giai đoạn, người ta dựa vào kích thước của khối u nguyên phát, mức độ xâm nhập vào mô xung quanh, mức độ di căn vào các hạch bạch huyết và di căn xa.
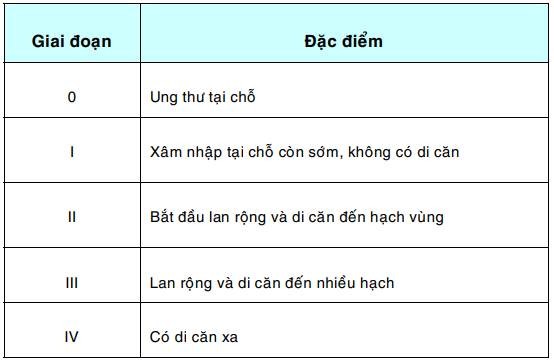
Thí dụ : Ung thư cổ tử cung được xếp thành 5 giai đoạn như sau:
Nếu ung thư cổ tử cung được phát hiện sớm ở giai đoạn 0 thì khả năng chữa khỏi bằng phương pháp điều trị tại chỗ đơn giản như khoét chóp là 100%; trái lại khi đã ở vào giai đoạn IV thì coi như không còn khả năng chữa khỏi, dù với bất kỳ phương pháp điều trị nào.
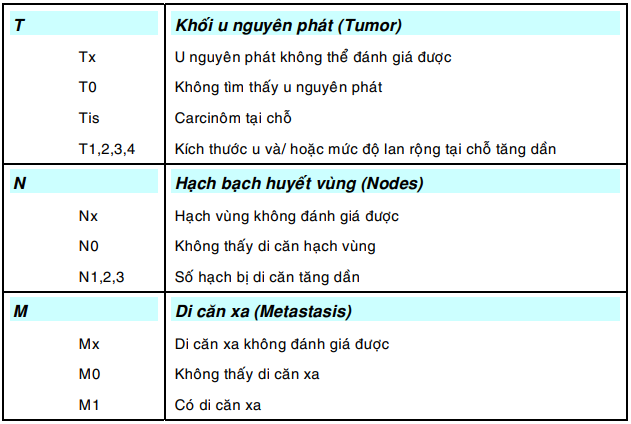
Để việc xếp giai đoạn ung thư mang tính khách quan, Hiệp hội quốc tế chống ung thư (UICC) đã đưa ra hệ thống xếp hạng TNM ( Tumor, Nodes, Metastasis) mà từ nhiều năm nay đã được áp dụng rộng rãi tại các cơ sở điều trị. Sau đây là các định nghĩa được dùng trong hệ thống này:
Các chất đánh dấu u (tumor marker):
Là các sản phẩm của tế bào u được phóng thích vào trong tuần hoàn. Định lượng huyết thanh các chất này có thể trợ giúp công tác chẩn đoán và theo dõi điều trị một số bệnh ung thư. Thí dụ:
Alpha fetoprotein (AFP) là 1 protein phôi được tìm thấy trong gan, túi noãn hoàng và ống tiêu hoá của phôi thai. AFP tăng cao trong các ung thư gan, ung thư tế bào mầm của tinh hoàn và buồng trứng
Kháng nguyên carcinôm phôi CEA (carcinoembryonic antigen) là 1 glycoprotein do gan, tuyến tụy và ống tiêu hoá của phôi thai sản xuất. CEA có thể tăng cao trong ung thư vú, buồng trứng, đại tràng, ung thư phổi loại tế bào nhỏ.
HCG (human chorionic gonadotropin) là 1 glycoprotein do hợp bào nuôi sản xuất, tăng cao trong các u tế bào nuôi
Calcitonin là 1 hormôn được sản xuất bởi tế bào C của tuyến giáp, tăng cao trong các ung thư tuyến giáp dạng tủy
Kháng nguyên đặc hiệu tuyến tiền liệt PSA ( Prostate specific antigen) là 1 protease do biểu mô tuyến tiền liệt sản xuất, tăng cao trong ung thư tuyến tiền liệt.
Phosphatase acid tuyến tiền liệt - PAP (prostatic acid phosphatase) tăng cao ở những bệnh nhân bị ung thư di căn tuyến tiền liệt.
Lactate dehydrogenase (LDH) tăng cao ở những bệnh nhân bệnh bạch cầu, u hắc tố, các limphôm.
Enolase đặc hiệu nơron NSE ( Neuron specific enolase) là 1 glycoprotein có nguồn gốc thần kinh, tăng cao trong các u thần kinh nội tiết, u nguyên bào thần kinh.
Kháng nguyên ung thư CA (cancer antigen) là các glycoprotein không thấy ở tế bào bình thường nên rất có giá trị trong tầm soát ung thư. Có nhiều loại CA khác nhau: CA 15-3, tăng cao trong ung thư vú; CA 19-9, tăng cao trong ung thư tuyến tụy; CA 72-4, tăng cao trong ung thư vú và buồng trứng; CA-125, tăng cao trong ung thư buồng trứng.
Tầm soát ung thư:
Khả năng chữa khỏi một ung thư tùy thuộc rất lớn vào việc phát hiện sớm khi nó còn trong thời kỳ tiền lâm sàng. Sự hiểu biết rõ hơn về bản chất của mỗi loại ung thư cùng với kết quả điều tra dịch tễ học cho phép xác định các nhóm nguy cơ cao để từ đó tìm ra những biện pháp tầm soát thích hợp. Sau đây là chế độ tầm soát một số loại ung thư thường gặp do Hiệp hội ung thư Hoa kỳ ACS (American Cancer Society) đề nghị:
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









