️ Hiểu về chẩn đoán và điều trị đột quỵ không rõ nguồn gốc
NHỮNG ĐIỂM QUAN TRỌNG
Đột quỵ không rõ nguồn gốc (CS: Cryptogenic Stroke) được định nghĩa là nhồi máu não không rõ ràng là do thuyên tắc từ tim, xơ vữa động mạch lớn hay bệnh động mạch nhỏ mặc dù đã kiểm tra tích cực.
Khoảng 1/4 đột quỵ thiếu máu cục bộ được phân loại là không rõ nguồn gốc (gần 175.000 case đột quỵ hàng năm ở Hoa Kỳ).
Khả năng xác định rõ hơn nguyên nhân của CS có ý nghĩa đối với việc điều trị tiếp theo và nguy cơ tái phát các biến cố. Hầu hết các bệnh nhân bị CS được điều trị bằng sự kết hợp giữa liệu pháp kháng tiểu cầu và giảm yếu tố nguy cơ đột quỵ - các phương pháp điều trị hiệu quả không cao trong việc ngăn ngừa đột quỵ có nguồn gốc tim mạch tái phát.
Chụp cộng hưởng từ (MRI) và chụp cắt lớp vi tính (CT) có độ nhạy tương tự đối với xuất huyết nội sọ cấp tính; tuy nhiên, MRI vượt trội so với CT trong việc phát hiện đột quỵ thiếu máu cục bộ.
Chụp hình ảnh mạch máu tiêu chuẩn có thể không phát hiện được trong các trường hợp đột quỵ do mảng bám bên trong lòng mạch mà không có hẹp đáng kể hoặc mảng bám dưới chỗ hẹp bị loét (ulcerated substenotic plaque).
Siêu âm tim qua thực quản (TEE) vượt trội hơn so với siêu âm tim qua thành ngực (TTE) trong việc loại trừ các nguồn gốc tim mạch gây đột quỵ.
Các nguyên nhân khác gây CS (ví dụ, tồn tại lỗ bầu dục [PFO], thrombophilia di truyền, mảng bám quai động mạch chủ, nhiễm trùng, tự miễn, tình trạng viêm…) nên được xem xét sau khi loại trừ các nguyên nhân phổ biến hơn.
Theo dõi tim dài hạn đối với rung nhĩ (AF) có thể có lợi ở những bệnh nhân bị CS và có khả năng thay đổi cách điều trị.
The American Stroke Association’s Cryptogenic Stroke Initiative, do Medtronic tài trợ, buộc các bên liên quan chính tăng cường nỗ lực xác định rõ nguyên nhân của CS, thúc đẩy trách nhiệm để cải thiện việc chăm sóc cho những bệnh nhân này và ngăn ngừa đột quỵ tái phát, từ đó giảm tỷ lệ tử vong và tàn tật do đột quỵ
GIỚI THIỆU: ĐỘT QUỴ KHÔNG RÕ NGUỒN GỐC (CRYPTOGENIC STROKE)
Đột quỵ là một cuộc khủng hoảng sức khỏe cộng đồng lớn ở Hoa Kỳ và trên toàn thế giới. Chỉ riêng tại Hoa Kỳ, ước tính khoảng 7 triệu người ≥ 20 tuổi đã bị đột quỵ (ngoại suy đến năm 2016 bằng cách sử dụng dữ liệu NHANES 2013-2016).1 Mỗi năm, có khoảng 795.000 người trải qua một cơn đột quỵ mới hoặc tái phát, và hơn 142000 người chết vì đột quỵ, khiến nó trở thành nguyên nhân gây tử vong đứng hàng thứ năm.1 Đột quỵ là một nguồn đáng kể của khuyết tật dài hạn, với phần lớn bệnh nhân gặp phải ít nhất một số sự suy yếu còn dư lại sáu tháng sau biến cố.1
Đột quỵ là một thực thể không đồng nhất trên lâm sàng. Khoảng 87% đột quỵ là thiếu máu cục bộ, 10% là xuất huyết nội sọ và 3% là xuất huyết dưới nhện.1 Đột quỵ thiếu máu cục bộ có một số loại phụ (Hình 1). Trong số đó, hai loại phổ biến nhất là đột quỵ do xơ vữa động mạch lớn (~ 30%) và có lẽ đáng ngạc nhiên là đột quỵ không rõ nguồn gốc, hay còn gọi là CS (~ 25%). Nhìn chung, đột quỵ có nguồn gốc tim mạch chiếm khoảng 20% đột quỵ do thiếu máu cục bộ. Mặc dù tỷ lệ chính xác của CS chưa được biết, nhưng ước tính có thể là khoảng 25%.2 Ngoại suy từ thống kê tỷ lệ mắc hiện tại, điều này cho thấy rằng có gần 175.000 đột quỵ hàng năm mà không có nguyên nhân rõ ràng nào có thể được phân biệt.
CS đặt ra một câu hỏi hóc búa lâm sàng đặc biệt ở chỗ, trong trường hợp không có nguyên nhân rõ ràng, các phương thức điều trị xuôi dòng (downstream treatment) thích hợp nhất được đề nghị là giáo dục ở mức tốt nhất. Làm phức tạp thêm cơ chế của nguyên nhân gây CS là bản chất không đồng nhất của phân nhóm này - ví dụ, nó có thể được gây ra bởi một số cơ chế chứ không phải là một cơ chế chính (ví dụ, xơ vữa động mạch lớn). Một số cơ chế tiềm ẩn cho CS đã được xác định.3
Khả năng xác định rõ hơn nguyên nhân của đột quỵ có ý nghĩa sâu sắc đối với việc điều trị tiếp theo và quan trọng hơn là nguy cơ tái phát các biến cố. Thuyên tắc từ tim thứ phát sau cơn rung nhĩ kịch phát khó nhận biết (AF) có thể là nguyên nhân phổ biến của giả CS.3 Các cơ chế bổ sung bao gồm - nhưng không giới hạn – là tình trạng thuyên tắc nghịch lý thứ phát do PFO (tồn tại lỗ bầu dục) hoặc các bất thường vách liên nhĩ khác,4,5 thrombophilia (bao gồm các tình trạng tăng đông như các tình trạng liên quan đến kháng thể kháng phospholipid hoặc tăng đông liên quan đến ung thư),6 viêm nội tâm mạc không do vi khuẩn, và bệnh mạch máu não tiền lâm sàng hoặc cận lâm sàng.
Hiện nay, phần lớn bệnh nhân bị CS đều được điều trị kháng tiểu cầu để phòng ngừa đột quỵ thứ phát.7 Do sự thiếu hiệu quả tương đối của các thuốc chống kết tập tiểu cầu trong điều trị đột quỵ do thuyên tắc từ tim, việc xác định cơn rung nhĩ kịch phát trong bối cảnh sau đột quỵ - và đưa ra liệu pháp chống đông máu thích hợp – là rất quan trọng.
Hướng dẫn này nhằm làm rõ định nghĩa về CS ở người trưởng thành và cung cấp hướng dẫn về các phương thức chẩn đoán nên được sử dụng trước khi tuyên bố một đột quỵ là “không rõ nguồn gốc”. Hơn nữa, hướng dẫn này khám phá những lợi ích lâm sàng của các khoảng thời gian theo dõi khác nhau sau đột quỵ để phát hiện rung nhĩ ở những bệnh nhân bị CS.
CRYPTOGENIC STROKE LÀ GÌ?
Phân loại CS được sử dụng lần đầu tiên trong NINDS (National Institute of Neurological Disorders and Stroke), 8,9 và sau đó được sửa đổi như một phần trong nỗ lực tinh chỉnh phân loại đột quỵ trong nghiên cứu TOAST (Trial of ORG 10172 in Acute Stroke Treatment).10 Như được trình bày trong Bảng 1, TOAST10 (là sơ đồ phân loại được sử dụng phổ biến nhất trong thực hành lâm sàng), định nghĩa CS (đột quỵ do nguyên nhân không xác định) là nhồi máu não không liên quan đến thuyên tắc từ tim, xơ vữa động mạch lớn hoặc xơ vữa động mạch lớn bệnh động mạch nhỏ mặc dù đã kiểm tra mạch máu, tim và huyết thanh tích cực. Lưu ý rằng phân loại TOAST bao gồm ≥ 2 nguyên nhân có vẻ hợp lý tương đương nhau thì được phân loại theo nguyên nhân không xác định. Sự thống nhất giữa các bên rất kém đối với các đột quỵ không rõ nguyên nhân sử dụng tiêu chí TOAST11
.png)
*Có thể hoặc có khả năng xảy ra tùy thuộc vào kết quả của các xét nghiệm hỗ trợ
Mặc dù tiêu chí TOAST xác định rõ ràng rằng CS là một loại đột quỵ mà chưa biết nguyên nhân, nhưng họ không chỉ ra các phương thức chẩn đoán cụ thể cần phải âm tính để tuyên bố đột quỵ nào là CS. Các tiêu chí khác, chẳng hạn như Hệ thống phân loại nguyên nhân (CCS: Causative Classification System) yêu cầu chụp hình ảnh não, chụp mạch máu não và đánh giá chức năng tim.12 Hệ thống phân loại này phân chia CS thành ―cryptogenic embolism‖ (thuyên tắc không rõ nguồn gốc) và ―other cryptogenic‖ (không rõ nguồn gốc khác) – đề cập đến một cơn đột quỵ có bằng chứng chụp mạch máu có hình ảnh cắt cụt phù hợp với cục máu đông, trong khi các động mạch nội sọ khác trông bình thường, bằng chứng hình ảnh của sự tái tạo hoàn toàn của động mạch bị tắc trước đó, hoặc sự hiện diện của nhiều nhồi máu cấp tính đã xảy ra gần đây có liên quan chặt chẽ về thời gian mà không phát hiện được bất thường trong các mạch máu tương ứng. Thuật ngữ ―other cryptogenic stroke‖ được dành riêng cho những đột quỵ không đáp ứng đầy đủ các tiêu chí của cryptogenic embolism.
CHẨN ĐOÁN CS
KIỂM TRA TỐI THIỂU
Theo guidelines, các đánh giá cơ bản ở mức tối thiểu nên bao gồm:13
CT hoặc MRI não không thuốc
Glucose máu
Độ bão hòa oxy
Điện giải đồ/chức năng thận
Công thức máu, bao gồm cả số lượng tiểu cầu
Men tim
Prothrombin time/International Normalized Ratio (INR)
APTT (Activated partial thromboplastin time)
Điện tim
KIỂM TRA BỔ SUNG
Khi nó là một chẩn đoán loại trừ, thì ước tính tỷ lệ đột quỵ được phân loại là không rõ nguyên nhân sẽ giảm. Rõ ràng là chẩn đoán đột CS có thể thay đổi tùy thuộc vào trung tâm, phương thức chẩn đoán có sẵn và kinh nghiệm của bác sĩ. Nghiên cứu CRYSTAL AF (The Cryptogenic Stroke and Underlying Atrial Fibrillation) đã sử dụng một phương pháp loại trừ nghiêm ngặt để xác định bệnh nhân CS. Trong nghiên cứu này, đột quỵ chỉ được phân loại là CS sau khi xét nghiệm tích cực bao gồm ECG 12 đạo trình, monitoring ECG 24 giờ hoặc hơn, siêu âm tim qua thực quản, sàng lọc các tình trạng tăng đông/huyết khối (ở bệnh nhân < 55 tuổi) và chụp cộng hưởng từ mạch máu (MRA), chụp cắt lớp vi tính mạch máu (CTA), hoặc chụp động mạch ở đầu và cổ. Siêu âm động mạch cổ và siêu âm Doppler xuyên sọ của các mạch máu nội sọ, thay cho MRA hoặc CTA vùng đầu và cổ, được phép cho bệnh nhân trên 55 tuổi.
Việc phân loại một trường hợp đột quỵ riêng lẻ là ―cryptogenic‖ (không rõ nguồn gốc) có thể thay đổi tùy thuộc vào bối cảnh chăm sóc và các kỹ thuật sẵn có. Con đường chẩn đoán chuẩn xác được sử dụng trong CRYSTAL AF có thể không khả thi về mặt kỹ thuật trong các bệnh viện không phải là trung tâm học thuật lớn hoặc không phải trong một thử nghiệm lâm sàng.
CÁC DẤU HIỆU TRÊN HÌNH ẢNH NÃO
CT sọ não không thuốc là không tốn kém và hiệu quả cao để loại trừ xuất huyết nội sọ, tuy nhiên, nó là kém nhất để xác định những ổ nhồi máu nhỏ. MRI có độ nhạy tương tự CT đối với xuất huyết nội sọ cấp tính, nhưng vượt trội hơn nhiều so với CT trong việc phát hiện đột quỵ thiếu máu cục bộ. Trong một nghiên cứu, MRI đã phát hiện đột quỵ thiếu máu cục bộ cấp tính ở 46% bệnh nhân, so với 10% ở CT. Nói chung, khi thực hành lâm sàng, nếu có sẵn thì MRI nên được ưu tiên hơn CT cho hình ảnh ban đầu của bệnh nhân đột quỵ. Các dấu hiệu trên diffusion-weighted MRI cũng có thể giúp xác định cơ chế đột quỵ; ví dụ, nhiều tổn thương ở các vùng mạch máu khác nhau có thể gợi ý, nhưng không chứng minh được nguồn gốc là do tim mạch. Ngược lại, các tổn thương rải rác giới hạn trong vùng phân phối của một mạch máu duy nhất gợi ý, nhưng không chứng minh được là do xơ vữa động mạch lớn. Một số tác giả cho rằng những bệnh nhân CS có bằng chứng lâm sàng và CT của một tổn thương do thiếu máu cục bộ có thể được hưởng lợi từ MRI đánh giá sau đó để phân định rõ hơn các nguyên nhân có thể.
MRI có độ nhạy tương tự như CT đối với xuất huyết nội sọ cấp tính, nhưng vượt trội hơn CT trong phát hiện đột quỵ thiếu máu cục bộ.
CÁC DẤU HIỆU TRÊN HÌNH ẢNH MẠCH MÁU
Hình ảnh mạch máu đặc biệt hữu ích để xác định bệnh nhân mắc bệnh xơ vữa động mạch lớn. Một số phương thức có sẵn bao gồm siêu âm, MRA và CTA. Trong khi chụp mạch qua catheter là tiêu chuẩn vàng để chẩn đoán bệnh lý xơ vữa động mạch nội sọ, vì là một thủ thuật xâm lấn có nguy cơ mang lại biến chứng thần kinh (2,5%) và đột quỵ tàn tật (0,1%), nên nó không được sử dụng thường quy. Xét nghiệm hình ảnh tiêu chuẩn có thể không phát hiện được trong các trường hợp đột quỵ do mảng bám trong lòng mạch mà không bị hẹp đáng kể hoặc mảng bám dưới chỗ hẹp bị loét, mặc dù ý nghĩa sau cùng là nguyên nhân gây đột quỵ vẫn được xác nhận. Những bất thường như vậy có thể được phát hiện bởi các chuỗi xung MRI tập trung vào thành mạch chứ không phải là lòng mạch. Chụp MRI cổ với các chuỗi xung xóa mỡ (fat-suppressed sequences) có thể hữu ích trong chẩn đoán bóc tách động mạch cổ, đặc biệt ở những bệnh nhân trẻ tuổi.
XÉT NGHIỆM TIM MẠCH
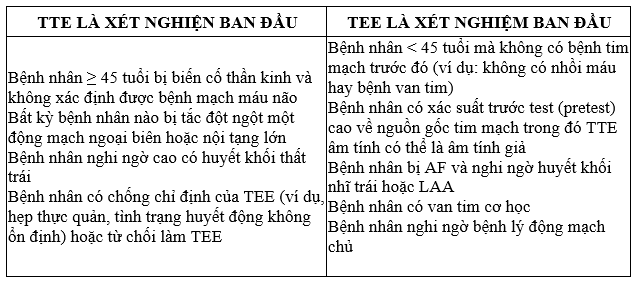
Siêu âm tim qua thành ngực (TTE) và siêu âm tim qua thực quản (TEE) có lợi ích lâm sàng đáng kể ở những bệnh nhân bị CS, tuy nhiên, việc lựa chọn phương thức siêu âm tim phải tùy từng trường hợp cụ thể (Bảng 2). Đáng chú ý là một nghiên cứu trên bệnh nhân đột quỵ thiếu máu cục bộ với nguyên nhân không rõ (trước khi làm siêu âm tim) đã đánh giá bệnh nhân với cả TTE và TEE.
Khi nguyên nhân đột quỵ chưa được xác định bằng các biện pháp thông thường, cần xem xét TEE để giúp xác định nguyên nhân đột quỵ và hướng dẫn các chiến lược phòng ngừa đột quỵ.
Trong nghiên cứu này, một nguồn gốc tim mạch có khả năng đã được xác định ở 55% bệnh nhân; trong số này, 16% được xác định trên cả TTE và TEE và 39% chỉ được xác định trên TEE.19 Những dữ liệu này cho thấy TEE có thể vượt trội hơn TTE trong việc xác định hoặc loại trừ nguồn gốc tim mạch của đột quỵ; hơn nữa, họ đề nghị rằng khi chưa xác định được nguyên nhân đột quỵ bằng các biện pháp thông thường, cần xem xét TEE để giúp xác định nguyên nhân đột quỵ và hướng dẫn các chiến lược phòng ngừa đột quỵ.
Table 2. Khi nào TTE hoặc TEE có thể được sử dụng làm xét nghiệm ban đầu?
XÉT NGHIỆM MÁU
Glucose máu thường tăng ở những bệnh nhân bị đột quỵ, vì tăng đường huyết có thể gây ra các dấu hiệu và triệu chứng khu trú bắt chước đột quỵ; hơn nữa, tăng đường huyết có liên quan đến các kết cục không thuận lợi.20 Các nguyên nhân khác của đột quỵ - ví dụ như nhiễm trùng, tự miễn và viêm, là rất hiếm và chỉ nên được xem xét khi xét nghiệm ban đầu không xác định được nguyên nhân.15. Hơn nữa, xét nghiệm bệnh thrombophilia di truyền ở bệnh nhân CS là rất tốn kém và có hiệu suất chẩn đoán cực kỳ thấp.
MONITORING TIM MẠCH
Các nghiên cứu cho thấy rằng có tới 30% bệnh nhân CS có thể đã có cơn rung nhĩ kịch phát không được phát hiện trước đó,14 tuy nhiên, vẫn còn nhiều tranh cãi về phương pháp tối ưu để tìm kiếm khả năng rung nhĩ ở bệnh nhân CS. Việc xác định rung nhĩ là rất quan trọng vì rõ ràng là nó sẽ dẫn dắt mô hình quản lý sau đột quỵ.
Trước đây, theo dõi tại bệnh viện và chuỗi ECG là cách duy nhất để phát hiện AF sau đột quỵ. Công nghệ Holter và các công nghệ mới hơn khác sau đó đã cho phép các cuộc kiểm tra mở rộng hơn. Hiện tại, các guidelines khuyến nghị monitoring tim liên tục trong ít nhất 24 giờ đầu sau đột quỵ.13 Đối với những bệnh nhân bị đột quỵ thiếu máu cục bộ cấp tính hoặc TIA không có nguyên nhân rõ ràng nào khác (ví dụ, đột quỵ không rõ nguồn gốc), guidelines AHA / ACC / HRS 2019 mới nhất về rung nhĩ cho thấy việc sử dụng một thiết bị theo dõi tim bên trong (insertable heart monitor) để đánh giá AF là hợp lý nếu kết quả từ thiết bị theo dõi tim bên ngoài không thuyết phục.
Một phân tích đo tim di động từ xa (MCT: mobile cardiac telemetry) tối đa 30 ngày đã báo cáo rung nhĩ mới hoặc thầm lặng ở khoảng 30% bệnh nhân CS.23 Nghiên cứu EMBRACE (The 30-Day Cardiac Event Monitor Belt for Recording Atrial Fibrillation After a Cerebral Ischemic Event) theo dõi biến cố tim mạch trong 30 ngày ở 572 bệnh nhân ≥ 55 tuổi bị đột quỵ không rõ nguồn gốc, nhưng không có rung nhĩ trước đó để theo dõi ECG lưu động không xâm lấn bằng một thiết bị ghi ghi lại các biến cố trong 30 ngày hoặc thiết bị theo dõi 24 giờ thông thường. Rung nhĩ kéo dài ≥ 30 giây được phát hiện ở 16,1% ở nhóm can thiệp, so với 3,2% của nhóm đối chứng.24 Điều quan trọng là những phát hiện này có tác động lớn đến lựa chọn điều trị: Sau 90 ngày, liệu pháp chống đông bằng đường uống đã được chỉ định trong 18,6% ở nhóm can thiệp so với 11,1% ở nhóm đối chứng.
Do tính chất thường không có triệu chứng và tính kịch phát của rung nhĩ, những bệnh nhân bị CS mà không phát hiện thấy rung nhĩ lúc ban đầu có thể cần phải theo dõi lâu dài hơn, điều này có thể không thực tế với các thiết bị mắc bên ngoài cơ thể. Thiết bị theo dõi tim bên trong (ICM : Insertable cardiac monitor) có thể có tiện ích lâm sàng ở những bệnh nhân như vậy. Những nghiên cứu nhỏ về thiết bị ICM ở bệnh nhân bị CS đã chứng minh hiệu suất phát hiện rung nhĩ từ 8,9% đến 33,7%.
Thử nghiệm CRYSTAL AF đã đánh giá giá trị của thiết bị ICM trong một thử nghiệm ngẫu nhiên lớn hơn, được thiết kế phù hợp.14. Nghiên cứu đã chọn ngẫu nhiên 441 bệnh nhân được chẩn đoán CS sau một protocol sàng lọc nghiêm ngặt với việc theo dõi bằng thiết bị ICM hoặc theo dõi thông thường. Sau sáu tháng, rung nhĩ được phát hiện với tỷ lệ 8,9% ở nhánh ICM, so với 1,4% ở nhóm đối chứng (hazard ratio 6,4; 95% CI 1,9 đến 21,7; P < 0,001). Sau 12 tháng, rung nhĩ được phát hiện với tỷ lệ 12,4% ở nhánh ICM so với 2,0% ở nhóm đối chứng (hazard ratio 7,3; 95% CI 2,6 đến 20,8; P < 0,001). Sau 36 tháng, tỷ lệ phát hiện lần lượt là 30,0% so với 3,0%. Ở thời điểm12 tháng, 97,0% bệnh nhân ở nhánh ICM được phát hiện rung nhĩ đã và đang được dùng thuốc kháng đông đường uống. Những dữ liệu này cho thấy rằng rung nhĩ là phổ biến ở những bệnh nhân CS, và không có gì đáng ngạc nhiên - là một bệnh nhân được theo dõi càng lâu, thì càng có nhiều khả năng rung nhĩ sẽ được phát hiện
PHÁT HIỆN RUNG NHĨ ẨN GIẤU (OCCULT AF*)
Khoảng 10% bệnh nhân bị đột quỵ thiếu máu cục bộ cấp tính hoặc TIA sẽ được phát hiện rung nhĩ mới trong khi nằm viện; tuy nhiên, có thể phát hiện thêm 11% rung nhĩ nếu được kiểm tra trong vòng 30 ngày sau khi xuất viện bằng cách theo dõi điện tâm đồ liên tục. Các protocol giám sát dài hơn lên đến sáu tháng đã mang lại tỷ lệ phát hiện tương tự. Trong các bệnh nhân đột quỵ hoặc TIA có chỉ định đặt máy tạo nhịp tim, việc kiểm tra thiết bị này đã xác định tỷ lệ mắc rung nhĩ ẩn giấu là 28% trong một năm. Một tỷ lệ rung nhĩ ẩn giấu tương tự đã được báo cáo ở những bệnh nhân không đột quỵ có nguy cơ cao thông qua các thiết bị tạo nhịp tim được cấy ghép. Rung nhĩ ẩn giấu được phát hiện trong quá trình kiểm tra máy tạo nhịp ở bệnh nhân không bị đột quỵ hoặc dân số hỗn hợp có liên quan đến tăng nguy cơ đột quỵ.
Đối với những bệnh nhân bị đột quỵ thiếu máu cục bộ cấp tính hoặc TIA mà không có nguyên nhân rõ ràng nào khác, việc theo dõi nhịp kéo dài (≈30 ngày) cho rung nhĩ là hợp lý trong vòng 6 tháng kể từ khi xảy ra biến cố (Class IIa; Level of Evidence C) 29
Khuyến cáo này phù hợp với các nghiên cứu được công bố, EMBRACE và CRYSTAL AF. Cả hai đều lưu ý rằng một tỷ lệ đáng kể bệnh nhân bị rung nhĩ ẩn giấu được phát hiện trong vòng 30 ngày theo dõi.
Các guidelines gần đây của AHA/ACC/HRS khuyến cáo rằng, ở những bệnh nhân bị CS (ví dụ đột quỵ không rõ nguyên nhân) thì việc theo dõi bằng các thiết bị lưu động bên ngoài là không thuyết phục, việc cấy máy theo dõi nhịp tim (loop recorder) là hợp lý để tối ưu hóa việc phát hiện rung nhĩ thầm lặng (Class IIa; Level of Evidence B-R).22
Table 3 Phác thảo các chiến lược theo dõi có thể và tỷ lệ phần trăm trong việc phát hiện rung nhĩ của từng phương thức.
Table 3. Loại theo dõi và phát hiện rung nhĩ ở những bệnh nhân CS 15
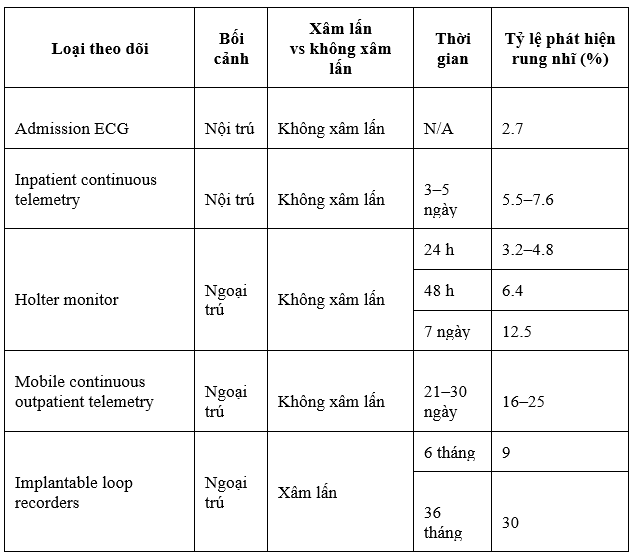
Yaghi S, Elkind MS. Cryptogenic stroke: A diagnostic challenge. Neurol Clin Pract. 2014;4:386-393.
QUẢN LÝ CS (ĐỘT QUỴ KHÔNG RÕ NGUỒN GỐC)
Điểm cốt lõi của các chiến lược phòng ngừa đột quỵ ở bệnh nhân CS là sự kết hợp giữa liệu pháp kháng tiểu cầu và điều chỉnh các yếu tố nguy cơ của đột quỵ.31 Các nghiên cứu cho thấy warfarin có thể có lợi hơn aspirin ở một số nhóm nhỏ bệnh nhân CS; tuy nhiên, phát hiện này đã không được nhân rộng trong các thử nghiệm ngẫu nhiên, mù đôi được thiết kế thích hợp.32 Vì vậy, việc xác định rung ở bệnh nhân CS là rất quan trọng, bởi vì trong quần thể bệnh nhân này, thuốc kháng đông rõ ràng được ưu tiên hơn so với liệu pháp kháng tiểu cầu.
1.Benjamin EJ, Muntner P, Alonso A, Bittencourt MS, Callaway CW, Carson AP, Chamberlain AM, Chang AR, Cheng S, Das SR, Delling FN, Djousse L, Elkind MSV, Ferguson JF, Fornage M, Jordan LC, Khan SS, Kissela BM, Knutson KL, Kwan TW, Lackland DT, Lewis TT, Lichtman JH, Longenecker CT, Loop MS, Lutsey PL, Martin SS, Matsushita K, Moran AE, Mussolino ME, O’Flaherty M, Pandey A, Perak AM, Rosamond WD, Roth GA, Sampson UKA, Satou GM, Schroeder EB, Shah SH, Spartano NL, Stokes A, Tirschwell DL, Tsao CW, Turakhia MP, VanWagner LB, Wilkins JT, Wong SS, Virani SS; on behalf of the American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics— 2019 update: a report from the American Heart Association. Circulation. 2019;139:e1–e473. doi:10.1161/CIR.0000000000000659.
2.Saver, JL. Cryptogenic Stroke. N Engl J Med 2016;374:2065-74.
3.Robert G. Hart, MD; Luciana Catanese, MD; Kanjana S. Perera, MBBS; George Ntaios, MD, PhD; Stuart J. Connolly, MD. Embolic Stroke of Undetermined Source A Systematic Review and Clinical Update. Stroke. 2017;48:867-872.
4.Pearson AC, Nagelhout D, Castello R, Gomez CR, Labovitz AJ. Atrial septal aneurysm and stroke: a transesophageal echocardiographic study. J Am Coll Cardiol. 1991;18:1223-1229.
5.Cabanes L, Mas JL, Cohen A, et al. Atrial septal aneurysm and patent foramen ovale as risk factors for cryptogenic stroke in patients less than 55 years of age. A study using transesophageal echocardiography. Stroke. 1993;24:1865-1873.
6.Haeusler KG, Herm J, Hoppe B, et al. Thrombophilia screening in young patients with cryptogenic stroke. Prevalence of gene polymorphisms compared to healthy blood donors and impact on secondary stroke prevention. Hamostaseologie. 2012;32:147-152.
7.Lars Søndergaard, M.D., Scott E. Kasner, M.D., John F. Rhodes, M.D., Grethe Andersen, M.D., D.M.Sc., Helle K. Iversen, M.D., D.M.Sc., Jens E. Nielsen-Kudsk, M.D., D.M.Sc., Magnus Settergren, M.D., Ph.D., Christina Sjöstrand, M.D., Ph.D., Risto O. Roine, M.D., David Hildick- Smith, M.D., J. David Spence, M.D., and Lars Thomassen, M.D. for the Gore REDUCE Clinical Study Investigators. Patent Foramen Ovale Closure or Antiplatelet Therapy for Cryptogenic Stroke. N Engl J Med 2017; 377:1033-1042.
8.Kunitz SC, Gross CR, Heyman A, et al. The pilot Stroke Data Bank: definition, design, and data. Stroke. 1984;15:740-746.
9.Foulkes MA, Wolf PA, Price TR, Mohr JP, Hier DB. The Stroke Data Bank: design, methods, and baseline characteristics. Stroke. 1988;19:547-554.
10.Adams HP, Jr., Bendixen BH, Kappelle LJ, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993;24:35-41.
11.Meschia JF, Barrett KM, Chukwudelunzu F, et al. Interobserver agreement in the trial of org 10172 in acute stroke treatment classification of stroke based on retrospective medical record review. J Stroke Cerebrovasc Dis. 2006;15:266-272.
12.Arsava EM, Ballabio E, Benner T, et al. The Causative Classification of Stroke system: an international reliability and optimization study. Neurology. 2010;75:1277-1284.
13.Jauch EC, Saver JL, Adams HP, Jr., et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013;44:870-947.
14.Sanna T, Diener HC, Passman RS, et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med. 2014;370:2478-2486.
15.Yaghi S, Elkind MS. Cryptogenic stroke: A diagnostic challenge. Neurol Clin Pract. 2014;4:386-393.
16.Chalela JA, Kidwell CS, Nentwich LM, et al. Magnetic resonance imaging and computed tomography in emergency assessment of patients with suspected acute stroke: a prospective comparison. Lancet. 2007;369:293-298.
17.Kang DW, Chalela JA, Ezzeddine MA, Warach S. Association of ischemic lesion patterns on early diffusion-weighted imaging with TOAST stroke subtypes. Arch Neurol. 2003;60:1730-1734.
18.Manning WJ. Echocardiography in detection of cardiac and aortic sources of systemic embolism. Available at: http://www.uptodate.com/contents/echocardiography-in-detection-of-cardiac-and- aortic-sources-of-systemic-embolism. Accessed May 9, 2019.
19.de Bruijn SF, Agema WR, Lammers GJ, et al. Transesophageal echocardiography is superior to transthoracic echocardiography in management of patients of any age with transient ischemic attack or stroke. Stroke. 2006;37:2531-2534.
20.Olsen TS. Blood glucose in acute stroke. Expert Rev Neurother. 2009 Mar;9(3):409-19.
21.Morris JG, Singh S, Fisher M. Testing for inherited thrombophilias in arterial stroke: can it cause more harm than good? Stroke. 2010;41:2985-2990.
22.January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ACC/ HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. 2019;139.
23.Glotzer TV, Ziegler PD. Cryptogenic stroke: Is silent atrial fibrillation the culprit? Heart Rhythm. 2015;12:234-241.
24.Gladstone DJ, Spring M, Dorian P, et al. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med. 2014;370:2467-2477.
25.Cotter PE, Martin PJ, Ring L, Warburton EA, Belham M, Pugh PJ. Incidence of atrial fibrillation detected by implantable loop recorders in unexplained stroke. Neurology. 2013;80:1546-1550.
26.Ritter MA, Kochhauser S, Duning T, et al. Occult atrial fibrillation in cryptogenic stroke: detection by 7- day electrocardiogram versus implantable cardiac monitors. Stroke. 2013;44:1449-1452.
27.Etgen T, Hochreiter M, Mundel M, Freudenberger T. Insertable cardiac event recorder in detection of atrial fibrillation after cryptogenic stroke: an audit report. Stroke. 2013;44:2007-2009.
28.Rojo-Martinez E, Sandin-Fuentes M, Calleja-Sanz AI, et al. [High performance of an implantable Holter monitor in the detection of concealed paroxysmal atrial fibrillation in patients with cryptogenic stroke and a suspected embolic mechanism]. Rev Neurol. 2013;57:251-257.
29.Kernan WN, Ovbiagele B, Black HR, et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2014;45:2160-2236.
30.Lewalter T. and Boriani G. Relevance of Monitoring Atrial Fibrillation in Clinical Practice Arrhythmia & Electrophysiology Review 2012;1:54–8.
31.Zhang C, Kasner S. Diagnosis, prognosis, and management of cryptogenic stroke. F1000Res. 2016 Feb 12;5.
32.Elkind MS. The role of warfarin and aspirin in secondary prevention of stroke. Curr Cardiol Rep. 2004 Mar;6(2):135-42.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









