️ Thoát vị đĩa đệm cột sống thắt lưng và hội chứng Guillain- Barre: Những triệu chứng dễ nhầm lẫn
I. Giới thiệu
Hội chứng Guillain-Barré là bệnh viêm đa dây thần kinh gây ra liệt thần kinh - cơ cấp tính. Tỷ lệ mắc bệnh dao động từ 0,8 đến 1,9 trường hợp trên 100.000 người ở Bắc Mỹ và Châu Âu. Hội chứng Guillain-Barré ảnh hưởng đến mọi người ở mọi chủng tộc và lứa tuổi, nhưng phổ biến ở độ tuổi trên 50 tuổi (1, 2) và cứ mỗi tăng lên 10 tuổi, tỷ lệ mắc bệnh tăng 20% (3). Tỷ lệ mắc bệnh hàng năm tăng từ 1,7 / 100.000 lên 3,3 / 100.000 sau 50 tuổi (1).
Các triệu chứng đầu tiên của hội chứng Guillain-Barré trong trường hợp điển hình là khó chịu, tê rần, dị cảm và yếu các chi. Ban đầu, sự thiếu hụt có thể ở gần, xa hoặc kết hợp cả hai và tiến triển nhanh chóng (4). Yếu cơ là triệu chứng có ở hầu hết các bệnh nhân, thường nổi trội hơn triệu chứng rối loạn cảm giác và có thể là triệu chứng nổi bật nhất. Triệu chứng yếu cơ đối xứng và dị cảm thường bắt đầu ở hai chân và lan dần tới hai tay. Đôi khi các triệu chứng này lại bắt đầu ở hai tay hoặc đầu. Ở 90% bệnh nhân, triệu chứng yếu cơ diễn ra nặng nhất ở tuần thứ 3 đến thứ 4. Phản xạ gân xương mất. Thường không có rối loạn cơ tròn. Yếu cơ kéo dài trong một khoảng thời gian nhưng tình trạng nặng thường xảy ra trong 1 tuần, sau đó đỡ dần. Khi khám lâm sàng, giảm phản xạ gân xương hoặc mất. Chẩn đoán nói chung là rõ ràng (5). Tuy nhiên, chẩn đoán hội chứng Guillain-Barré rất khó khăn ở những bệnh nhân yếu cơ không đối xứng, ở những người chỉ bị yếu ở chi dưới hoặc ở những người có triệu chứng thoát vị đĩa đệm.
Trong bài viết, chúng tôi tập trung vào chẩn đoán với các triệu chứng lâm sàng tiến triển kèm rối loạn chức năng tự chủ, cũng như những hiểu biết gần đây về cơ chế bệnh sinh của hội chứng. Hơn nữa, mô hình tiên lượng và các lựa chọn điều trị hiện tại có sẵn trong hội chứng Guillain-Barré được thảo luận. Kết hợp các phát triển mới nhất trong nghiên cứu và thử nghiệm lâm sàng để đưa đến các lựa chọn điều trị thích hợp nhất cho bệnh nhân.
II. Báo cáo trường hợp lâm sàng
Bệnh nhân nam 30 tuổi đến phòng cấp cứu vì đau thắt lưng, tê bì và yếu hai chi dưới. Các triệu chứng đã bắt đầu một ngày trước đó, sau khi mang một chiếc hộp nặng và ngày càng trở nên nặng nề hơn. Bệnh nhân không có tiền sử tiêm phòng gần đây hoặc các bệnh truyền nhiễm. Đôi khi, bệnh nhân gặp vấn đề về đau lưng và phải điều trị bằng thuốc. Khám lâm sàng: Cơ lực 4/5 ở chi dưới bên trái và 4 + / 5 ở chi dưới bên phải. Tê rần không tương quan đén phân bố da ở chi dưới. Chức năng cảm giác bình thường ở chi dưới. Các phản xạ gân xương đều giảm, bao gồm gân cơ nhị đầu, gân gối và gân gót Achille, dấu hiệu Babinski và dấu hiệu Lasègue đều âm tính. Không thể đánh giá dáng đi do yếu cơ.
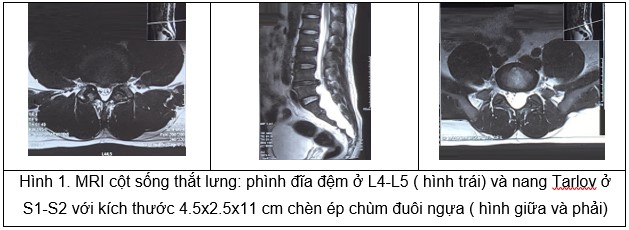
Bệnh nhân được chẩn đoán: Thoát vị đĩa đệm thắt lưng L4-L5 với nang Tarlov ở S1-S2 theo dõi biểu hiện của hội chứng Guillain-Barré. Sau khi được theo dõi sát lâm sàng và hội chần với chuyên khoa nội thần kinh, bệnh nhân được điều trị trao đổi huyết tương, quá trình trao đổi huyết tương đã bắt đầu trong 4 ngày với lượng khoảng ba lít huyết tương mỗi ngày. Mười ngày sau khi xuất hiện các triệu chứng, tình trạng yếu của anh ấy bắt đầu cải thiện. Bệnh nhân đã có thể đi lại với sự trợ giúp ở ngày 11. Một tháng sau khi các triệu chứng bắt đầu, bệnh nhân không còn tê rần, đau lưng và yếu cơ, triệu chứng đã cải thiện rất nhiều. Bệnh nhân có thể đi lại mà không cần sự trợ giúp nhưng vẫn còn tập tễnh và tê bì ở các chi dưới.
III. Bàn luận
Nguyên nhân chính gây ra liệt thần kinh cơ là hội chứng Guillain Barré (GBS), và được đề cập rất nhiều trên toàn thế giới, hội chứng Guillain-Barré là bệnh viêm đa dây thần kinh do viêm cấp tính (acute inflammatory demyelinating polyradiculoneuropathy -AIDP), dựa trên bằng chứng về sự tấn công hệ miễn dịch myelin cấp tính và tương tự như viêm dây thần kinh dị ứng trên thực nghiệm. Bệnh viêm đa dây thần kinh do viêm cấp tính (AIDP) là loại tiền-týp của hội chứng Guillain-Barré và được mô tả là quá trình khử men thần kinh ngoại biên và rễ tủy sống. Có tới 90% các trường hợp hội chứng Guillain-Barré ở Bắc Mỹ và Châu Âu (6) nhưng chỉ có 22–46% các trường hợp ở Trung Quốc, Nhật Bản, Ấn Độ, Đông Nam Á và Mexico (7). Bệnh lý này được đặc trưng bởi sự thoái hóa bao myelin do sự phát triển phức hợp Ig tấn công màng trên bề mặt ngoài của tế bào Schwann. Không có mối liên hệ rõ ràng giữa bệnh viêm đa dây thần kinh do viêm cấp tính (AIDP) và các kháng thể antiganglioside (8). Gần đây, bệnh viêm đa dây thần kinh do viêm cấp tính (AIDP) được mô tả hội chứng Guillain-Barre tiền-týp và các bệnh đa dây thần kinh miễn dịch khác đã được nhóm lại và đặt tên là hội chứng Guillein-Barre gây ra tình trạng yếu toàn thân ngay lập tức nhưng với các nguyên nhân và sinh lý bệnh khác nhau. Các dạng hội chứng Guillein-Barre này thường bao gồm các dưới typ sợi trục của hội chứng Guillein-Barre, trong đó thoái hóa sợi trục và khử men không phân đoạn là bệnh lý chính, bao gồm bệnh thần kinh trục vận động cấp tính (acute motor axonal neuropathy - AMAN), rối loạn vận động đơn thuần và bệnh thần kinh trục cảm giác vận động cấp tính (acute motor sensory axonal neuropathy - AMSAN) hoặc cấp tính cảm biến hỗn hợp trục điện từ động cơ (acute mixed sensor motor axonopathy - AMSAN) (7) .
Đặc điểm lâm sàng : Hội chứng Guillein Barre chủ yếu là bệnh lý thần kinh vận động ở dạng bình thường, trong khi dị cảm vùng cùng cụt hầu như luôn xuất hiện khi bệnh khởi phát. Cảm giác tê rần, hoặc châm chích thường đi kèm với yếu chân đối xứng và đi lại khó khăn trong vài giờ hoặc vài ngày. Sự hiện diện của dị cảm vùng cùng cụt làm tăng khả năng chẩn đoán hội chứng Guillein Barre (9). Biểu hiện thường gặp khi đi lên cầu thang hoặc ngồi trong nhà vệ sinh. Yếu cơ từ xa đến gần phổ biến hơn nhưng yếu cơ ở gần lại nghiêm trọng hơn ở xa. Đôi khi, yếu cơ lan đến các chi trên dẫn đến liệt tăng dần. Nếu bệnh tiến triển, có thể có yếu cơ duy nhất ở chân hoặc, ngoài ra, yếu cơ cũng có thể xảy ra ở bàn tay hoặc xương bả vai và liên quan đến chân. Khoảng 70% bệnh nhân không có phản xạ gân cơ sâu khi khám lần đầu tiên. Cho đến khi tình trạng mệt mỏi hoặc mất cảm giác tiến triển, các phản xạ đôi khi vẫn còn kích thích. Ở những chi quá yếu để chống lại trọng lực, phản xạ hầu như luôn luôn không thể đạt được. Hầu hết bệnh nhân phàn nàn về cảm giác "châm chích", "tê rần", cùng với "cảm giác rủ" ở cánh tay hoặc chân. So với các bệnh đa dây thần kinh trục phụ thuộc vào chiều dài khác, dị cảm ở đầu ngón tay đôi khi xảy ra ở bệnh nhân hội chứng Guillein Barre ngay sau khi bàn chân bị ảnh hưởng, và thường xảy ra trước đó. Khi bệnh tiến triển, các dấu hiệu cảm giác đối xứng và thường xảy ra trước sự mệt mỏi trong một vài ngày, trước khi tăng dần đến mắt cá chân và cổ tay. Bệnh nhân cũng có thể nhận thấy cảm giác tê, nặng vùng cùng cụt khi bệnh tiến triển. Một số trường hợp giảm cảm giác trên thân mình và xác định được mức độ cảm giác rõ ràng theo khoang tủy, nhưng chỉ đến mức thay đổi cảm giác đáng kể chứ không phải giảm đau dưới mức tổn thương. Một triệu chứng phổ biến nhưng không được đánh giá cao của hội chứng Guillein-Barre là đau. Đau ở 1/3 số bệnh nhân có thể kèm theo khi bắt đầu yếu cơ sau 2 tuần (10) , Khoảng 2/3 số bệnh nhân bị đau nhẹ ở giai đoạn đầu của bệnh (11). Sự không thoải mái của hội chứng Guillein-Barre được định nghĩa là (1) đau, thường giới hạn ở lưng, hông hoặc cơ bắp chân (loại phổ biến nhất); (2) châm chích, đau lan tỏa từ lưng đến một hoặc cả hai chân; hoặc (3) mãn tính và không ngừng, cảm giác nóng rát, rối loạn dị cảm ở các chi xa (10-12). Hiếm khi, đau lưng và đau lan có thể báo trước tình trạng yếu cơ và dị cảm, do đó được cho là do đau thần kinh tọa hoặc rối loạn cột sống (12). Ở khoảng 20-30% bệnh nhân hội chứng Guillein-Barre , sự suy yếu của cơ hoành dẫn đến suy hô hấp và nhu cầu thông khí hỗ trợ xảy ra. Sau 2 tuần kể từ khi bệnh diễn ra, nếu tình trạng yếu cơ hoành và cơ hô hấp mà chưa xảy ra thì không cần thông khí hỗ trợ trừ khi dẫn đến các vấn đề về phổi hoặc bệnh lý khác (7).
Chẩn đoán: hội chứng Guillein-Barre vẫn là một chẩn đoán toàn diện về một chứng rối loạn mà không có xét nghiệm chẩn đoán cụ thể nào (5). Đối với hội chứng Guillein-Barre điển hình: Yếu cơ có thể ảnh hưởng đến tất cả các cơ ở chi như nhau, hoặc chủ yếu là các chi ở xa hoặc gần ở tay hoặc chân. Ít nhất ở các chi bị ảnh hưởng, bệnh nhân giảm hoặc không có phản xạ gân cơ sâu. Ở những bệnh nhân nghi ngờ hội chứng Guillein-Barre, hầu như luôn luôn tiến hành chọc dò dịch não tủy. Thông thường, xét nghiệm dịch não tủy cho thấy protein tăng cao với số lượng tế bào bình thường. Điện dẫn truyền và điện cơ đồ đóng một vai trò rất quan trọng trong chẩn đoán, phân loại các phân nhóm và xác nhận bệnh lý thần kinh ngoại vi (4, 13 . Các bất thường trong các nghiên cứu về dẫn truyền thần kinh được thấy ở 95% các trường hợp, và những phát hiện này được thấy ở nhiều điểm khác nhau trong suốt quá trình của bệnh ở một số lượng đáng kể bệnh nhân hội chứng Guillein-Barre (14). Trong những trường hợp này, có thể cần phải kiểm tra lại sau 1 đến 2 tuần để xác định chẩn đoán (4, 13). Điều quan trọng là phải đánh giá kỹ lưỡng nhiều dây thần kinh và nhiều đoạn dây thần kinh ở nhiều chi, bao gồm đánh giá sóng F, phản xạ H và phản xạ chớp mắt. Điện dẫn truyền bằng chứng chứng minh về sự khử men thần kinh đa ổ mắc phải, dấu hiệu của viêm đa rễ thần kinh cấp tính, chiếm phần lớn bệnh nhân hội chứng Guillein-Barre ở phương Tây (6) . Sóng F và phản xạ H ở bệnh nhân này: Mất phản xạ H, sóng F, thần kinh chi dưới bị kéo dài. Mức độ protein trong dịch não tủy tăng cao ở hầu hết bệnh nhân tại bất kỳ thời điểm nào trong suốt quá trình của bệnh. Nồng độ protein trong dịch não tủy tăng cao chỉ xuất hiện ở 50% bệnh nhân trong tuần đầu tiên của bệnh, và tăng lên 75% vào tuần thứ ba (9). Nguyên nhân của tăng protein dịch não tủy không được biết rõ nhưng có khả năng là do bất thường hàng rào máu-dịch não tủy do viêm ở mức độ của rễ thần kinh cột sống.
MRI cột sống là một xét nghiệm chẩn đoán được đề xuất bởi một số tác giả để bổ sung và chẩn đoán loại trừ các rối loạn hệ thần kinh trung ương có thể giống với hội chứng Guillein-Barre như trong bài báo cáo của chúng tôi. MRI cột sống với Gadolinium giúp chẩn đoán sớm trong quá trình bệnh trong khi các xét nghiệm chẩn đoán khác vẫn có thể mang lại kết quả bình thường (15). MRI cột sống thắt lưng thường bất thường và hình ảnh chèn ép chùm đuôi ngựa với gadolinium. Điều này xảy ra ở 80-90% bệnh nhân, đặc biệt ở trẻ em và bệnh nhân bị yếu cơ nghiêm trọng và đau chân và lưng trầm trọng (7). Những dấu hiệu và triệu chứng này thường là hai bên nhưng có thể không đối xứng (16). Có thể khó chẩn đoán hội chứng Guillein-Barre, đặc biệt ở những bệnh nhân bị thoát vị đĩa đệm có triệu chứng từ trước và hẹp ống sống do đĩa đệm thoát vị lớn. Trong trường hợp hiện tại, chùm đuôi ngựa bị chèn ép bởi thoát vị đĩa đệm ở mức độ L4-L5 và bởi nang Tarlov ở mức độ S1-S2 với kích thước 4,5x2,5x11 cm. Chúng tôi tập trung vào triệu chứng đau, yếu liệt tiến triển của bệnh nhân. Nhưng so sánh, liệt kê tiến triển nhanh chóng đã được trình bày ở bệnh nhân và điều này gợi ý đến hội chứng Guillein-Barre hơn là thoát vị đĩa đệm và u nang Tarlov.
Điều trị: Trao đổi huyết tương (plasma exchange - PE) đã được sử dụng như một phương thức điều trị trong nhiều rối loạn tự miễn dịch, bao gồm các tình trạng thần kinh, chẳng hạn như hội chứng Guillain-Barré và bệnh đa dây thần kinh do viêm mãn tính (chronic inflammatory demyelinating polyradiculoneuropathy - CIDP). Dựa trên các bằng chứng, Hiệp hội Apheresis Hoa Kỳ (ASFA) khuyến cáo về việc sử dụng liệu pháp thẩm tách máu 3 năm một lần. Các hướng dẫn của ASFA bao gồm việc sử dụng liệu pháp trao đổi huyết tương như một phương pháp trị liệu đầu tay được chấp nhận trong cả hội chứng Guillein-Barre và bệnh đa dây thần kinh do viêm mãn tính, đơn độc và/hoặc kết hợp với các phương pháp điều trị khác. Vai trò của liệu pháp thẩm tách máu trong những tình huống này đã được thảo luận và các khía cạnh kỹ thuật khác nhau của quy trình trao đổi huyết tương đã được thảo luận, chẳng hạn như đo lượng thẩm tách máu, số lần thay thể tích, dịch thay thế và điều trị các biến chứng có thể xảy ra (17). Khi được sử dụng trong vòng 4 tuần đầu tiên kể từ khi khởi phát, trao đổi huyết tương có lợi, nhưng khi họ thử bắt đầu nó sớm hơn (tức là trong vòng 2 tuần đầu tiên), hiệu quả lớn nhất đã được tìm thấy (18, 19). Ngoài ra, nghiên cứu về trao đổi huyết tương ở Bắc Mỹ là thử nghiệm lớn đầu tiên chứng minh tác động có lợi của liệu pháp miễn dịch đối với hội chứng Guillein-Barre (18). Sau khi công bố những phát hiện này, Ig tĩnh mạch trong 5 ngày liên tục ở chế độ 0,4 g/kg thể trọng hàng ngày đã thay thế liệu pháp trao đổi huyết tương là phương pháp điều trị ưa thích ở nhiều trung tâm trong 5 ngày liên tiếp ở chế độ 0,4 g/kg thể trọng hàng ngày, chủ yếu vì sự tiện lợi và sẵn có. Tổng quan của Cochrane về việc sử dụng Ig tĩnh mạch trong hội chứng Guillein-Barre gồm bốn thử nghiệm bổ sung (20). Không có sự khác biệt giữa Ig tĩnh mạch và trao đổi huyết tương về sự thay đổi mức độ suy giảm sau 4 tuần, thời gian thở máy, tỷ lệ tử vong hoặc tàn tật còn lại.
Trong trường hợp của chúng tôi, một nang Tarlov, được ghi nhận ban đầu trên MRI. Nang Tarlov là tình trạng giãn màng não của các rễ thần kinh chứa đầy dịch não tủy, thường nằm trong ống sống của phần tủy sống S1-S5 (21). Căn nguyên của nang Tarlov vẫn chưa được biết rõ, mặc dù nhiều giả thuyết có thể là bẩm sinh hoặc mắc phải đã được đưa ra. Các nguyên nhân bẩm sinh bao gồm các bệnh mô liên kết như hội chứng Loeys Dietz, Ehlers-Danlos và Marfan, trong khi các nguyên nhân mắc phải bao gồm viêm nang rễ thần kinh, mở rộng màng nhện xung quanh và xung quanh rễ thần kinh, tích tụ mô tủy sống xuất huyết, và phá vỡ dẫn lưu tĩnh mạch thứ phát do lắng đọng haemosiderin sau chấn thương (22). Nang Tarlov có thể gây đau lưng, đau thần kinh tọa, đau tầng sinh môn, mông và chi dưới cũng như rối loạn chức năng sinh dục, tiết niệu và ruột, nhưng MRI thường bị bỏ qua hoặc được cho là ít có giá trị trong việc phát triển đau lưng (23). Bệnh nhân của chúng tôi: biểu hiện yếu chi dưới nghi ngờ tổn thương hội chứng chùm đuôi ngựa cấp tính, chụp MRI cột sống thắt lưng được chỉ định và tình cờ phát hiện nang Tarlov 4,5 x 2,5 x 11 cm. Các phương pháp phổ biến nhất để chẩn đoán nang Tarlov là MRI và chụp tủy CT, nhưng MRI xương cùng chuyên dụng nhạy hơn (23). Các lựa chọn điều trị bao gồm dẫn lưu dịch não tủy vùng thắt lưng không phẫu thuật và dẫn lưu qua da các u nang, và các lựa chọn phẫu thuật khác như cắt bỏ thành nang, mở bản sống giải áp, tái tạo và đóng các vạt cơ. Gần đây, các kỹ thuật ít xâm lấn hơn đã được xác định để điều trị nang Tarlov, bao gồm cả phương pháp hai kim được sử dụng trong trường hợp này. Lidocain hoặc Marcaine được đưa vào các nang trước khi tiến hành thủ thuật này. Đây là một thủ thuật kiểm tra thực tế để đánh giá liệu u nang có triệu chứng hay không (22) .
IV. Kết luận
Khả năng nhầm lẫn các triệu chứng và dấu hiệu không điển hình của hội chứng Guillein-Barre với các triệu chứng của thoát vị đĩa đệm cột sống thắt lưng do thiếu các xét nghiệm có độ nhạy cao, đặc biệt là giai đoạn đầu của bệnh. Để điều trị thích hợp và ngăn ngừa phẫu thuật không cần thiết do thoát vị đĩa đệm gây hẹp ống sống thắt lưng, cần theo dõi chặt chẽ diễn biến lâm sàng, kết hợp với hình ảnh cộng hưởng từ bổ sung và cũng như nghi ngờ về khả năng hội chứng Guillein-Barre là quan trọng.
Tài liệu tham khảo
1. McGrogan A, Madle GC, Seaman HE, de Vries CS. The epidemiology of Guillain-Barré syndrome worldwide. A systematic literature review. Neuroepidemiology. 2009;32(2):150-63. Epub 2008/12/18. doi: 10.1159/000184748. PubMed PMID: 19088488.
2. van der Maas NA, Kramer MA, Jacobs BC, van Soest EM, Dieleman JP, Kemmeren JM, et al. Guillain-Barré syndrome: background incidence rates in The Netherlands. Journal of the peripheral nervous system : JPNS. 2011;16(3):243-9. Epub 2011/10/19. doi: 10.1111/j.1529-8027.2011.00356.x. PubMed PMID: 22003939.
3. Sejvar JJ, Baughman AL, Wise M, Morgan OW. Population incidence of Guillain-Barré syndrome: a systematic review and meta-analysis. Neuroepidemiology. 2011;36(2):123-33. Epub 2011/03/23. doi: 10.1159/000324710. PubMed PMID: 21422765; PubMed Central PMCID: PMCPMC5703046.
4. Hughes RA, Cornblath DR. Guillain-Barré syndrome. Lancet (London, England). 2005;366(9497):1653-66. Epub 2005/11/08. doi: 10.1016/s0140-6736(05)67665-9. PubMed PMID: 16271648.
5. van Doorn PA, Ruts L, Jacobs BC. Clinical features, pathogenesis, and treatment of Guillain-Barré syndrome. The Lancet Neurology. 2008;7(10):939-50. Epub 2008/10/14. doi: 10.1016/s1474-4422(08)70215-1. PubMed PMID: 18848313.
6. Hadden RD, Cornblath DR, Hughes RA, Zielasek J, Hartung HP, Toyka KV, et al. Electrophysiological classification of Guillain-Barré syndrome: clinical associations and outcome. Plasma Exchange/Sandoglobulin Guillain-Barré Syndrome Trial Group. Annals of neurology. 1998;44(5):780-8. Epub 1998/11/18. doi: 10.1002/ana.410440512. PubMed PMID: 9818934.
7. Piccione EA, Salame K, Katirji B. Guillain-Barré Syndrome and Related Disorders. In: Katirji B, Kaminski HJ, Ruff RL, editors. Neuromuscular Disorders in Clinical Practice. New York, NY: Springer New York; 2014. p. 573-603.
8. Hiraga A, Kuwabara S, Ogawara K, Misawa S, Kanesaka T, Koga M, et al. Patterns and serial changes in electrodiagnostic abnormalities of axonal Guillain-Barré syndrome. Neurology. 2005;64(5):856-60. Epub 2005/03/09. doi: 10.1212/01.wnl.0000153071.71335.e9. PubMed PMID: 15753422.
9. Yuki N, Hartung HP. Guillain-Barré syndrome. The New England journal of medicine. 2012;366(24):2294-304. Epub 2012/06/15. doi: 10.1056/NEJMra1114525. PubMed PMID: 22694000.
10. Ruts L, Drenthen J, Jongen JL, Hop WC, Visser GH, Jacobs BC, et al. Pain in Guillain-Barre syndrome: a long-term follow-up study. Neurology. 2010;75(16):1439-47. Epub 2010/09/24. doi: 10.1212/WNL.0b013e3181f88345. PubMed PMID: 20861454.
11. Moulin DE, Hagen N, Feasby TE, Amireh R, Hahn A. Pain in Guillain-Barré syndrome. Neurology. 1997;48(2):328-31. Epub 1997/02/01. doi: 10.1212/wnl.48.2.328. PubMed PMID: 9040715.
12. Ropper AH, Shahani BT. Pain in Guillain-Barré syndrome. Archives of neurology. 1984;41(5):511-4. Epub 1984/05/01. doi: 10.1001/archneur.1984.04050170057018. PubMed PMID: 6721720.
13. Pithadia AB, Kakadia N. Guillain-Barré syndrome (GBS). Pharmacological reports : PR. 2010;62(2):220-32. Epub 2010/05/29. doi: 10.1016/s1734-1140(10)70261-9. PubMed PMID: 20508277.
14. Cornblath DR, Mellits ED, Griffin JW, McKhann GM, Albers JW, Miller RG, et al. Motor conduction studies in Guillain-Barré syndrome: description and prognostic value. Annals of neurology. 1988;23(4):354-9. Epub 1988/04/01. doi: 10.1002/ana.410230407. PubMed PMID: 3382170.
15. Mulkey SB, Glasier CM, El-Nabbout B, Walters WD, Ionita C, McCarthy MH, et al. Nerve root enhancement on spinal MRI in pediatric Guillain-Barré syndrome. Pediatric neurology. 2010;43(4):263-9. Epub 2010/09/15. doi: 10.1016/j.pediatrneurol.2010.05.011. PubMed PMID: 20837305.
16. Storm PB, Chou D, Tamargo RJ. Lumbar spinal stenosis, cauda equina syndrome, and multiple lumbosacral radiculopathies. Physical medicine and rehabilitation clinics of North America. 2002;13(3):713-33, ix. Epub 2002/10/17. doi: 10.1016/s1047-9651(02)00013-x. PubMed PMID: 12380555.
17. Pham HP, Schwartz J. Therapeutic Plasma Exchange in Guillain-Barre Syndrome and chronic inflammatory demyelinating polyradiculoneuropathy. Presse medicale (Paris, France : 1983). 2019;48(11 Pt 2):338-46. Epub 2019/11/05. doi: 10.1016/j.lpm.2019.03.016. PubMed PMID: 31679897.
18. Plasmapheresis and acute Guillain-Barré syndrome. The Guillain-Barré syndrome Study Group. Neurology. 1985;35(8):1096-104. Epub 1985/08/01. PubMed PMID: 4022342.
19. Raphaël JC, Chevret S, Hughes RA, Annane D. Plasma exchange for Guillain-Barré syndrome. The Cochrane database of systematic reviews. 2012(7):Cd001798. Epub 2012/07/13. doi: 10.1002/14651858.CD001798.pub2. PubMed PMID: 22786475.
20. Hughes RA, Raphaël JC, Swan AV, Doorn PA. Intravenous immunoglobulin for Guillain-Barré syndrome. The Cochrane database of systematic reviews. 2004(1):Cd002063. Epub 2004/02/20. doi: 10.1002/14651858.CD002063.pub2. PubMed PMID: 14973982.
21. TARLOV IM. PERINEURIAL CYSTS OF THE SPINAL NERVE ROOTS. Archives of Neurology & Psychiatry. 1938;40(6):1067-74. doi: 10.1001/archneurpsyc.1938.02270120017001.
22. Murphy KP, Ryan S. Shrinking of a Tarlov cyst. BMJ Case Rep. 2019;12(3):e227256. doi: 10.1136/bcr-2018-227256. PubMed PMID: 30852497.
23. Murphy K, Oaklander AL, Elias G, Kathuria S, Long DM. Treatment of 213 Patients with Symptomatic Tarlov Cysts by CT-Guided Percutaneous Injection of Fibrin Sealant. American Journal of Neuroradiology. 2016;37(2):373-9. doi: 10.3174/ajnr.A4517.









