️ Định lượng PAPP-A (Pregnancy- associated plasma protein A)
NGUYÊN LÝ
Nồng độ P PP- được xác định dựa trên phép phân tích miễn dịch hóa phát quang đánh dấu enzym (Enzyme-labeled chemiluminescent immunoassay).
Sau 30 phút ủ, phức hợp Sandwich được tạo thành, trong đó mẫu thử của người bệnh đóng vai trò kháng nguyên được kẹp giữa kháng thể kháng P PP- gắn với hạt bead và kháng thể kháng P PP- lien kết với enzyme LP. LP thủy phân cơ chất phát quang tín hiệu. Tín hiệu thu được tỷ lệ thuận với lượng P PP- trong mẫu thử.
CHUẨN BỊ
Người thực hiện: Bác sỹ, cử nhân được đào tạo sử dụng máy Immulite 2000
Phương tiện, hóa chất
Phương tiện: Hệ thống máy phân tích Immulite 2000 của hãng SIEMENS
Hóa chất:
Pha rắn: Hộp chứa hạt bead P PP-A
Chứa 200 hạt bead được phủ kháng thể đơn dòng kháng P PP- từ chuột
Bảo quản ổn định ở 2 – 8oC đến ngày hết hạn
Pha lỏng: Hộp chứa thuốc thử P PP-A
Chứa 11,5 mL enzym LP (từ ruột bê) liên hợp với kháng thể đơn dòng kháng PAPP- từ chuột, trong dung dịch đệm.
Bảo quản ổn định ở 2 – 8oC đến ngày hết hạn - Các dung dịch hiệu chuẩn ( djustor) P PP-A:
- 2 lọ chứa P PP- (mức thấp và mức cao) trong huyết thanh đông khô không có nguồn gốc từ người. Hoàn nguyên chất đông khô trong mỗi lọ với 2 mL nước cất hoặc nước đã khử ion, đảo trộn nhẹ nhàng để chất đông khô tan hoàn toàn.
Bảo quản ổn định ở 2 – 8oC trong 30 ngày sau khi pha, 3 tháng ở -20oC. - Các thành phần không được cung cấp kèm theo Kit:
- Dung dịch pha loãng mẫu: Multi-Diluent 2
- Cơ chất hóa phát quang (Chemiluminescent Substrate): là một ester phosphate của adamantyl dioxetane, bị thủy phân dưới xúc tác của enzym LP tạo thành một dạng trung gian không ổn định. Chất trung gian này nhanh chóng bị phá vỡ liên kết để chuyển thành dạng ổn định, đồng thời phát xạ ánh sáng.
- Dung dịch rửa các kim hút (Probe wash)
- Dung dịch vệ sinh các kim hút (Probe Cleaning Kit)
- Tube phản ứng, Tube mẫu
Dung dịch kiểm tra chất lượng (Control): 2 mức * Lưu ý:
- Chỉ sử dụng để chẩn đoán trong phòng thí nghiệm
- Thuốc thử được loại bỏ theo quy định
- Chất bảo quản Natri azide (dưới 0,1 g/dL). Khi xử lý phải dùng một lượng nước lớn để rửa, tránh sự ăn mòn đường ống.
- Cơ chất hoá phát quang: tránh nhiễm bẩn, tránh tiếp xúc trực tiếp với ánh sáng mặt trời.
- Nước: sử dụng nước cất hoặc nước đã khử ion.
Người bệnh: Thai phụ tham gia sàng lọc trước sinh ở quý I của thai kỳ (tuần thai từ 11 đến 14 tuần).
Phiếu xét nghiệm: theo mẫu quy định của Bệnh viện và của Bộ Y tế
CÁC BƯỚC TIẾN HÀNH
Bệnh phẩm
Mẫu phân tích: Huyết thanh hoặc huyết tương có chất chống đông heparin. Không sử dụng huyết tương có chất chống đông EDT.
Xử lý mẫu:
Đảm bảo cục máu đông co lại hoàn toàn trước khi ly tâm mẫu để tách huyết thanh, tránh nhiễu kết quả do sự có mặt của fibrin.
Khi sử dụng máu bị vỡ hồng cầu, việc đánh giá kết quả cần thận trọng.
Sử dụng máy siêu ly tâm để làm trong những mẫu có Lipid cao.
Thể tích mẫu cần thiết: 10 µl huyết thanh hoặc huyết tương.
Bảo quản: 24 giờ ở 2–8oC, 2 tháng ở (-20)oC.
Pha loãng mẫu: pha loãng mẫu trước khi phân tích nếu nghi ngờ mẫu có nồng độ PAPP- cao hơn ngưỡng đo của máy
Tiến hành kỹ thuật
Quy trình phân tích
Để có kết quả tối ưu, cần tuân thủ các bước của quy trình bảo trì theo sách hướng dẫn IMMULITE 2000. Bao gồm: chuẩn bị, cài đặt, hòa loãng, hiệu chỉnh đường chuẩn ( djustment), chạy kiểm tra chất lượng và phân tích.
Chu kỳ hiệu chỉnh lại đường chuẩn ( djustment) được khuyến cáo là 4 tuần, hoặc khi chạy kiểm tra chất lượng không đạt, hoặc khi thay Lot hóa chất mới.
Chạy kiểm tra chất lượng ít nhất là 2 mức (thấp và cao)
Chu kỳ ủ: 1 x 30 phút
Thời gian có kết quả đầu tiên: 35 phút
NHẬN ĐỊNH KẾT QUẢ
Hiển thị kết quả
Đơn vị đo: mIU/mL
Giới hạn đo: 0,025- 10 mIU/mL
Độ nhạy: 0,025 mIU/mL
Giá trị tham khảo
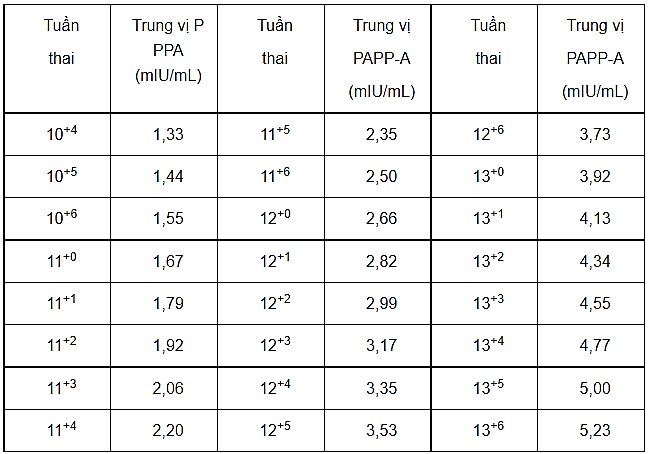
Mỗi Phòng thí nghiệm nên thiết lập một giá trị tham khảo riêng.
Đánh giá
Một số nghiên cứu chỉ ra rằng sự giảm nồng độ P PP- trong thai kỳ có liên quan đến những bất thường về nhiễm sắc thể của thai nhi.
Ở quý I của thai kỳ, sự kết hợp giữa tuổi mẹ, nồng độ fβ-HCG, PAPP-A trong huyết thanh mẹ và độ mờ da gáy của thai nhi làm tăng hiệu quả của sàng lọc trước sinh so với sàng lọc ở quý II.
SAI SÓT VÀ XỬ TRÍ
Hạn chế của phương pháp
Các kháng thể không đồng nhất trong huyết thanh người có thể phản ứng với các Ig trong thuốc thử gây nhiễu kết quả phân tích
Những người bệnh thường xuyên tiếp xúc với động vật hoặc các sản phẩm từ huyết thanh động vật cũng có thể gây nhiễu kết quả phân tích
Sử dụng kết quả phân tích với mục đích chẩn đoán, cần kết hợp với các triệu chứng lâm sàng và tiền sử bệnh của người bệnh.
Yếu tố gây nhiễu
Hiệu ứng High-dose Hook: ≥ 115 mIU/mL
Các mẫu huyết thanh có nồng độ T-Bilirubin > 200 mg/L (342 µmol/L), hoặc nồng độ Hb > 157 mg/dL, hoặc nồng độ TG > 3000 mg/dL (33,9 mmol/L) có thể ảnh hưởng đến kết quả. Do đó, không sử dụng các mẫu này để phân tích.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









