GIỚI THIỆU VỀ ĐỒ THỊ CWA (CLOT WAVEFORM ANALYSIS) CỦA XÉT NGHIỆM PT VÀ aPTT
Trong cơ thể con người, máu luôn được giữ ở trạng thái lỏng nhờ sự phối hợp hài hoà giữa hệ thống hoạt hóa và hệ thống ức chế quá trình đông máu. Nhờ sự cân bằng giữa hai hệ thống này, máu có thể dễ dàng lưu thông trong hệ tuần hoàn để duy trì sự sống. Những nguyên nhân làm mất đi tính ổn định của “cán cân” đông – cầm máu sẽ dẫn đến sự rối loạn huyết học trong cơ thể, để lại nhiều hậu quả vô cùng nghiêm trọng. Tình trạng tăng đông và xuất huyết là những hậu quả nghiêm trọng của sự rối loạn đông – cầm máu trong cơ thể, là nguyên nhân hàng đầu dẫn đến tình trạng tử vong do các bệnh lý như bệnh tim thiếu máu cục bộ, đột quỵ và xuất huyết do chấn thương. Cũng chính vì vậy, việc chẩn đoán kịp thời, phân tầng nguy cơ và theo dõi điều trị thuốc chống huyết khối hoặc thuốc cầm máu trở nên quan trọng và cấp thiết hơn bao giờ hết [1].
Nhờ sự phát triển không ngừng của khoa học kỹ thuật, nhiều kỹ thuật xét nghiệm mới đã ra đời và thúc đẩy mạnh mẽ lĩnh vực chẩn đoán và điều trị huyết học. Các xét nghiệm huyết học khảo sát và đánh giá hệ thống đông – cầm máu đang được sử dụng rộng rãi tại Việt Nam hiện nay bao gồm: Thời gian hoạt hóa thromboplastin từng phần (aPTT - activated Partial Thromboplastin Time);Thời gian prothrombin (PT – Prothrombin Time); Thời gian thrombin (TT – Thrombin Time); Đo độ đàn hồi cục máu đông (TEG - Thromboelastography); Khảo sát sự hình thành thrombin (TGT – Thrombin Generation Test).
Xét nghiệm thời gian aPTT và PT thực hiện theo nguyên tắc phát hiện điểm đông (clotting point), cho phép khảo sát thời gian đông máu con đường nội sinh (intrinsic pathway) và ngoại sinh (extrinsic pathway). Nhờ khả năng giúp cung cấp cái nhìn khái quát về hệ thống dòng thác đông máu nội sinh và ngoại sinh, đồng thời có chi phí phải chăng, việc thực hiện không quá phức tạp, nên hiện nay, hai loại xét nghiệm này được xem là đầu tay trên thực hành lâm sàng trong việc: (i) Khảo sát hoặc sàng lọc tình trạng rối loạn đông – cầm máu ban đầu do thiếu hụt yếu tố đông máu do di truyền hoặc mắc phải [2]; (ii) Chuẩn hoá và theo dõi điều trị thuốc kháng đông (thuốc kháng vitamin K và heparin)[3][4]. Mặc dù có nhiều ưu điểm, xét nghiệm aPTT và PT vẫn còn nhiều hạn chế về ý nghĩa lâm sàng. Thời gian đông của PT và aPTT chưa thể mô tả được khả năng hình thành cấu trúc thrombin (thrombin burst) và sự gia tăng quá trình kích hoạt đông máu của các phospholipid (enhancement of clotting activation by PLs), vốn là các yếu tố quan trọng trong tiên lượng nguy cơ xuất huyết trên lâm sàng và chẩn đoán hội chứng kháng phospholipid. Kết quả aPTT và PT không được sử dụng trong tiên lượng nguy cơ chảy máu và điều trị bệnh nhân xuất huyết cấp tính [1]
Phân tích biểu đồ đường cong đông máu (Clot waveform analysis) dựa trên xét nghiệm aPTT truyền thống hiện đang là một kỹ thuật đầy triển vọng do khả năng khảo sát sự hình thành thrombin thông qua biểu đồ sóng hình thành qua phản ứng đông máu. Trong phản ứng đông máu của xét nghiệm aPTT, sự hình thành cục đông theo thời gian làm thay đổi độ hấp thụ quang phổ (absorbance) hoặc mức độ ánh sáng truyền qua (transmittance) ống nghiệm phản ứng theo thời gian. Từ đây, bằng cách theo dõi tín hiệu quang theo từng 0,1 giây, dữ liệu thu thập được thuật toán – tin xử lý và xây dựng nên biểu đồ sóng hay biểu đồ đường cong đông máu ban đầu.
Biểu đồ đông máu thể hiện ba giai đoạn phân biệt (Hình 1): (i) Giai đoạn tiền đông máu hay giai đoạn kích hoạt yếu tố đông máu trong dòng thác đông máu (Vùng AB hình 1); (ii) Giai đoạn đông máu hay giai đoạn mà cấu trúc thrombin chuyển hoá phân tử fibrinogen thành mạng lưới sợi fibrin (Vùng BD hình 1); (iii) Giai đoạn sau đông máu hay giai đoạn ổn định hệ thống lưới fibrin trong ống nghiệm (Vùng DE hình 1).
.png)
Hình 1. Biểu đồ đường cong đông máu ban đầu
Từ đây, thông qua việc tính toán đạo hàm bậc một và bậc hai từ biểu đồ đường cong đông máu ban đầu, thuật toán – tin sẽ ghi nhận được 1) thời gian vận tốc tối đa, 2) thời gian gia tốc tối đa và 3) thời gian giảm tốc tối đa (Hình 2). Theo đó, thời gian vận tốc tối đa là thời điểm mà tại đó, vận tốc của phản ứng chuyển fibrinogen thành fibrin là nhanh nhất (tương ứng với điểm |min 1| trong đồ thị đạo hàm bậc 1). Thời gian gia tốc tối đa là thời điểm mà tại đó, gia tốc phản ứng chuyển fibrinogen thành fibrin là nhanh nhất (tương ứng với điểm |min 2| trong đồ thị của đạo hàm bậc 2). Thời gian giảm tốc tối đa là thời điểm mà tại đó, giảm tốc phản ứng chuyển fibrinogen thành fibrin là nhanh nhất (tương ứng với điểm |max 2| trong đồ thị của đạo hàm bậc 2). Ngoài ra, từ các dạng biểu đồ của CWA, ta có thể thu thập các thông số khác như chiều cao đỉnh sóng đạo hàm bậc 1, độ rộng, độ dốc..., đó là những thông số cũng đã được mô tả rằng sự thay đổi có ý nghĩa trong các bệnh lý huyết động học bệnh lý đông – cầm máu.[5,6]
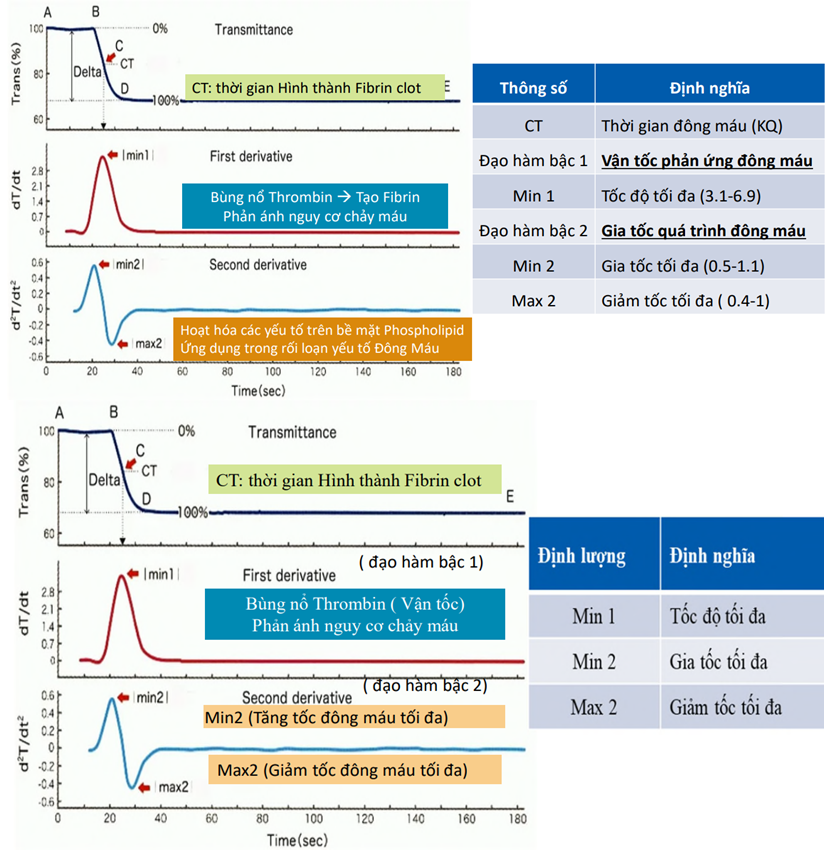
Hình 2. Các thông số kỹ thuật và ý nghĩa của chúng trong CWA.
CWA bước đầu đang dần được nghiên cứu và ứng dụng trong một số lĩnh vực như theo dõi quá trình đông máu nội mạch lan tỏa (DIC). Các nghiên cứu cho thấy CWA thậm chí có thể phát hiện DIC sớm hơn các phương pháp thông thường trong khoảng 19% trường hợp.[7] Nhiều nghiên cứu ủng hộ việc đưa CWA vào các khuyến nghị trong hướng dẫn chẩn đoán và điều trị DIC.[8]
CWA có thể giúp gợi ý phân biệt hay định hướng các loại thiếu hụt yếu tố đông máu dựa trên sự khác biệt về hình dạng đường cong đông máu. Tuy nhiên, kết quả không mang tính chất khẳng định loại yếu tố nào đang bị thiếu hụt và mức độ thiếu hụt của từng loại yếu tố. Cần phối hợp với các xét nghiệm định lượng yếu tố đông máu để chẩn đoán xác định và phân loại mức độ bệnh.[9]
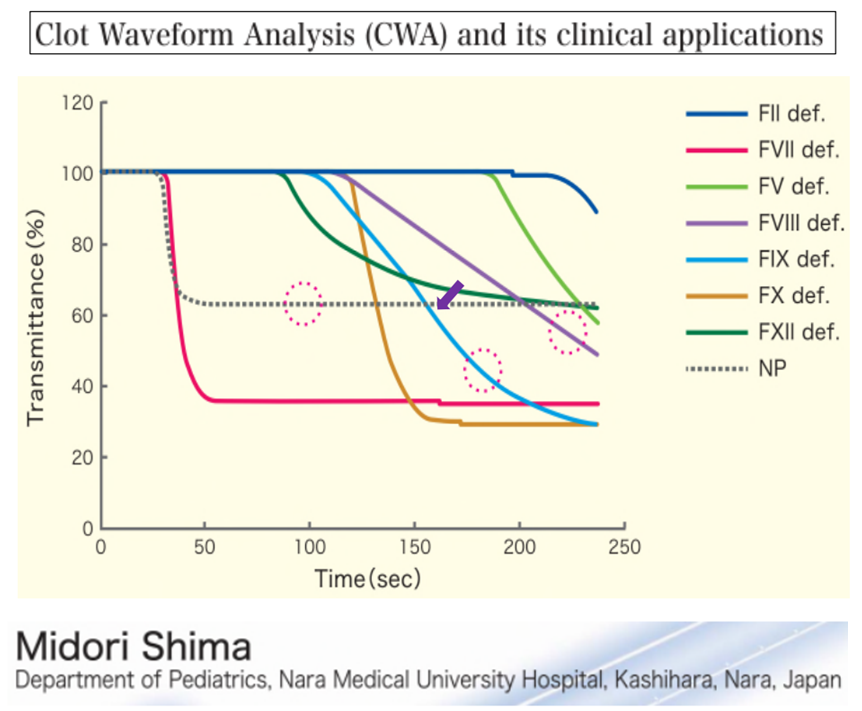
Hình 3. Ví dụ về ứng dụng lâm sàng của CWA trong định hướng chẩn đoán tình trạng thiếu hụt các yếu tố đông máu dựa trên hình dạng đường CWA (aPTT).
Một số nghiên cứu đã mô tả các đặc điểm của biểu đồ đường cong đông máu ở những bệnh nhân nhiễm trùng huyết nguy kịch. Kết quả chỉ ra rằng mức độ nghiêm trọng và tiên lượng của nhiễm trùng huyết có thể được dự đoán bởi CWA.[10]
Mặc dù CWA không tốn kém và dễ thực hiện nhưng nó vẫn còn tồn tại một số nhược điểm nhất định. Do CWA được thực hiện dựa trên kết quả của các xét nghiệm đo quang, chỉ số HIL (tán huyết – hemolysis; tăng bilirubin máu – icterus; tăng lipid máu – lipemia) có thể ảnh hưởng đến chất lượng kết quả xét nghiệm. Vì vậy, cần có quy trình thao tác chuẩn trong việc hướng dẫn thu thập và tiếp nhận bệnh phẩm kỹ càng để hạn chế nhất những mẫu có chỉ số HIL ảnh hưởng đến chất lượng xét nghiệm. Hiện nay, một số thiết bị xét nghiệm đông máu tự động như CS-2400/2500 (Sysmex), CN-3000/6000 (Sysmex) và ACL-TOP 550cts (Beckman Coulter),… được tích hợp tính năng đánh giá chỉ số HIL thông qua việc đo quang chất lượng mẫu huyết tương ban đầu bằng những bước sóng phù hợp, từ đó tính toán và đưa ra cảnh báo cho người phân tích kết quả. Tính năng này hỗ trợ việc phát hiện những mẫu có sự thay đổi chỉ số HIL mà mắt thường không thể nhận biết được cũng như cảnh báo chính xác ngưỡng chỉ số HIL có thể làm ảnh hưởng kết quả xét nghiệm đông máu.
Trong những năm gần đây, CWA dần được nghiên cứu và chứng minh tầm quan trọng trong chẩn đoán, tiên lượng và theo dõi điều trị bệnh lý huyết học. Tuy nhiên, các thông số kỹ thuật từ biểu đồ đường cong đông máu vẫn cần được quan tâm nghiên cứu một cách nghiêm túc, từ đó cung cấp thêm nhiều bằng chứng khoa học tin cậy trong việc xác nhận giá trị lâm sàng, tận dụng những ưu điểm sẵn có đồng thời bổ sung những khiếm khuyết giá trị lâm sàng của xét nghiệm PT và aPTT. Khoa Xét nghiệm Bệnh viện Nguyễn Tri Phương hiện nay, với hai hệ thống CN-6000 (Sysmex) và ACL-TOP 550 CTS (Beckman Coulter) đã xây dựng kế hoạch thực hiện chuỗi đề tài về đặc điểm đường cong đông máu trong bệnh lý tăng đông – huyết khối, đông máu nội mạch lan tỏa (DIC), trong các bệnh lý xơ gan nặng, nhiễm khuẩn huyết tại chính cơ sở y tế. Khoa Xét nghiệm mong muốn đóng góp những số liệu khoa học tin cậy và khách quan nhất, củng cố giá trị lâm sàng của CWA. Thông qua đó, nâng cao năng lực nghiên cứu khoa học và chất lượng dịch vụ xét nghiệm vì mục tiêu hoàn thiện từng ngày trên hành trình bảo vệ sức khỏe cộng đồng.
TÀI LIỆU THAM KHẢO
- Lancé MD. A general review of major global coagulation assays: thromboelastography, thrombin generation test and clot waveform analysis. Thrombosis journal. 2015; 13:1-6.
- Levy JH, Szlam F, Wolberg AS and Winkler A. Clinical use of the activated partial thromboplastin time and prothrombin time for screening: a review of the literature and current guidelines for testing. Clinics in Laboratory Medicine. 2014; 34(3):453-477.
- Samuelson BT, Cuker A and Siegal DM. Laboratory assessment of the anticoagulant activity of direct oral anticoagulants: a systematic review. Chest. 2017; 151(1):127-138.
- Platton S, Sivapalaratnam S and Raheja P. Diagnosis and laboratory monitoring of hemophilia A. Hematology. 2023; 2023(1):11-18.
- Wada H, Matsumoto T and Ohishi K. Update on the clot waveform analysis. Clinical Applied Thrombosis/Hemostasis. 2020; 26:1076029620912027.
- Suzuki K, Wada H and Matsumoto T. Usefulness of the APTT waveform for the diagnosis of DIC and prediction of the outcome or bleeding risk. Thrombosis Journal. 2019; 17:1-8.
- Bakhtiari K, Meijers JC and De Jonge E. Prospective validation of the International Society of Thrombosis and Haemostasis scoring system for disseminated intravascular coagulation. Critical care medicine. 2004; 32(12):2416-2421.
- Levi M, Toh C and Thachil J. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British journal of haematology. 2009; 145(1):24-33.
- Shima M. Understanding the hemostatic effects of recombinant factor VIIa by clot waveform analysis: Seminars in hematology 2004. Elsevier.
- Chopin N, Floccard B, Sobas F and Illinger J. Activated partial thromboplastin time waveform analysis: a new tool to detect infection? Critical care medicine. 2006; 34(6):1654-1660.









