️ Liệu pháp truyền máu trong bệnh β-Thalassemia thể nặng (P2)
CHẾ PHẨM MÁU DÀNH CHO NHỮNG BỆNH NHÂN ĐẶC BIỆT
Hồng cầu rửa có thể có ích cho những bệnh nhân thalassemia hay bị phản ứng dị ứng nặng tái diễn nhiều lần khi truyền máu. Việc rửa bằng nước muối sinh lý sẽ lấy đi những protein huyết tương mà nó là đích gây phản ứng cho kháng thể của người nhận. Những trường hợp khác cũng có thể cần hồng cầu rửa là trên những bệnh nhân thiếu hụt kháng thể IgA vì ở những bệnh nhân này có sẵn kháng thể thành lập trước đó chống IgA nên có thể gây phản ứng sốc phản vệ. Việc rửa hồng cầu thường không có kết quả làm giảm bạch cầu và không được dùng việc rửa hồng cầu thay cho phương pháp làm nghèo bạch cầu. Thay vào đó, việc rửa nên được thực hiện cùng với việc lọc. Ngoài ra, việc rửa hồng cầu có thể loại bỏ vài tế bào hồng cầu khỏi sản phẩm truyền máu, vì vậy nó có giá trị để theo dõi mức độ hemoglobin sau truyền máu để có thể đảm bảo đạt được mức hemoglobin đích.
Hồng cầu đông lạnh là hồng cầu được làm lạnh từ máu toàn phần, tốt nhất là trong vòng 7 ngày sau thu thập, dùng một chất bảo quản và lưu trữ ở nhiệt độ từ -600C đến -800C hoặc thấp hơn, tùy vào phương pháp sử dụng. Phương pháp trên được sử dụng để lưu trữ một số đơn vị máu hiếm cho những bệnh nhân có kháng thể hồng cầu bất thường hay các bệnh nhân thiếu hụt những kháng nguyên thông thường của hồng cầu. Hội đồng Châu Âu đang xây dựng một mạng lưới dự trữ nguồn máu hiếm mang tính quốc tế và có thể liên hệ với:
Hồng cầu được chiết tách từ một người cho máu. Phương pháp này lấy hai đơn vị hồng cầu của cùng một người cho để truyền cho một bệnh nhân từ đó sẽ làm giảm sự phơi nhiễm đối với nhiều người hiến máu và làm giảm các nguy cơ (i) nhiễm trùng và (ii) sự phát triển của phản ứng do kháng thể bất thường cũng như các biến chứng khác liên quan đến truyền máu.
Truyền hồng cầu trẻ hoặc non có vẻ làm giảm nhu cầu truyền máu (Spanos, 1996). Tuy nhiên, bệnh nhân sẽ bị nguy cơ tiếp xúc nhiều đối tượng cho máu, với giá thành cao hơn, nguy cơ mắc bệnh truyền nhiễm và hình thành các kháng thể bất thường.
Lưu trữ những đơn vị hồng cầu người cho
Các dung dịch bảo quản kháng đông sử dụng trong việc lưu trữ máu (xem Bảng 2a) được phát triển để phòng ngừa sự đông máu và cho phép lưu trữ máu trong khoảng thời gian nhất định. Tất cả những dung dịch đó chứa sodium citrate, acid citric và glucose, một số dung dịch có thể chứa adenine, guanosine và phosphate (như CPD-A).
Khi chuẩn bị điều chế hồng cầu đậm đặc, một phần đáng kể glucose và adenine sẽ bị lấy đi cùng với huyết tương. Nếu không bù lại, khả năng tồn tại của hồng cầu chỉ có thể được duy trì khi chúng không bị quá cô đặc. Vì vậy hồng cầu lắng trong môi trường CPD- adenine không nên để dung tích hồng cầu trung bình tăng cao trên 70% (CoE Re 2006). Tuy nhiên ngày nay với một số dung dịch phụ gia mới phát minh có thể cho phép duy trì khả năng sống của hồng cầu ngay cả khi đã lấy đi trên 90% huyết tương, vì các dung dịch trên chứa một lượng lớn các chất dinh dưỡng cần thiết (xem Bảng 2b). Sử dụng glucose và adenine cần thiết cho sự duy trì đời sống của hồng cầu sau truyền máu, phosphate được sử dụng để làm tăng tiêu glucose, và các chất khác (mannitol, citrate) được sử dụng để phòng ngừa tiêu huyết thực nghiệm. Sodium chloride hay di-sodium phosphate được dùng để tạo áp suất thẩm thấu thích hợp cho dung dịch treo bổ sung. Do đó các chất thêm vào ở Bảng 2b, ví dụ như là AS-1, AS-3, AS-5, giúp kéo dài đáng kể việc dự trữ hồng cầu lên đến 42 ngày.
Thời gian dự trữ tối đa (hạn sử dụng) được ghi chú trên mỗi đơn vị máu truyền khác nhau tùy theo cách điều chế (đậm độ hồng cầu, thành phần kháng đông, sử dụng các dung dịch treo bổ sung …) và cần xác định hình thức bảo quản máu dự trữ nào cũng phải đạt mục tiêu tối thiểu là số hồng cầu tồn tại sau 24 giờ truyền không được dưới 75%.
Chức năng phóng thích oxy của hemoglobin (rất quan trọng ở bệnh thalassemia thể nặng) bị ảnh hưởng trong suốt quá trình dự trữ do sự mất dần của 2, 3-biphosphoglycerate (2, 3-BPG, trước đây được biết như là 2, 3- diphosphoglycerate, DPG). Mặc dù lấy ví dụ như thời gian lưu trữ của máu toàn phần trong CPDA-1 là 35 ngày (CoE Re 2006), sau 10 ngày lưu trữ tất cả 2, 3-BPG đều bị mất (Coe Re 2006). Trong trường hợp các chất thêm vào đã được đề cập ở trên (xem Bảng 2b), mặc dù thời gian dự trữ được cho là lên đến 42 ngày và ATP nồng độ cao được duy trì đến ngày dự trữ thứ 28, giá trị của 2, 3-BPG và P50 không còn được duy trì trong khoảng thời gian này. Thêm vào đó những hiểu biết về thời gian bán hủy của tế bào hồng cầu trong cơ thể người nhận sau một thời gian dự trữ máu người cho lâu dài hiện còn hạn chế. Vì tất cả những lý do trên và thực tế đối với bệnh nhân thalassemia thể nặng, thời gian bán hủy của hồng cầu ngắn lại và thời gian phục hồi giảm có thể làm tăng số lần truyền máu và dẫn tới việc ứ sắt do truyền máu. Việc truyền máu ngày nay sử dụng các hồng cầu dự trữ trong các dung dịch thêm vào dưới 2 tuần, và thậm chí với CDP-A còn ngắn hơn nữa – càng tươi càng tốt. Ở những bệnh nhân mắc bệnh tim mạch và các trẻ nhỏ, đặc biệt chú ý đến việc tăng thể tích của các dung dịch treo bổ sung vào.
Nhìn chung, đối với tất cả các bệnh nhân, cần nên xem xét những đơn vị máu có Hct thấp do chứa các dung dịch treo bổ sung mới đây khi tính toán chỉ số của việc ứ sắt do truyền máu hằng năm (xem Bảng 2a & 2b).
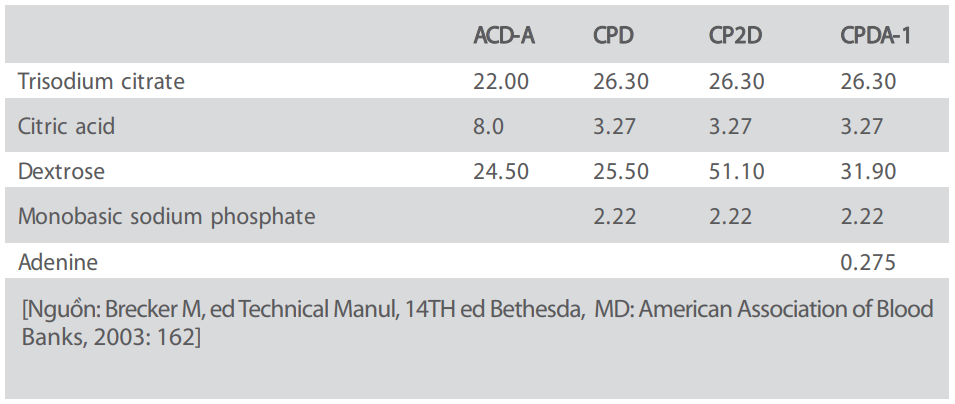
Bảng 2a: Thành phần của các dung dịch bảo quản chứa chất kháng đông (g/L)
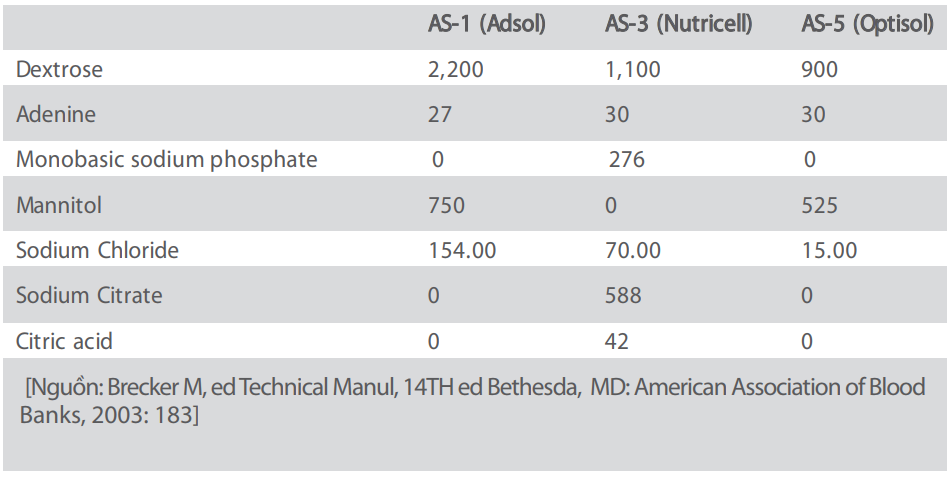
Bảng 2b: Thành phần của các dung dịch treo bổ sung (mg/100mL)
CHỨNG NGHIỆM PHÙ HỢP
Sự hình thành một hay nhiều các kháng thể bất thường là biến chứng thường gặp của truyền máu mạn tính (Spanos, 1990; Singer, 2000). Do đó cần kiểm soát cẩn thận xem bệnh nhân có xuất hiện kháng thể mới và loại bỏ ngay hồng cầu của người cho có chứa kháng nguyên tương ứng. Các kháng thể kháng Anti-E, anti-C và antiKell là thường gặp nhất. Tuy nhiên, 5-10% bệnh nhân có xuất hiện của kháng thể bất thường chống lại kháng nguyên của các hồng cầu hiếm và các kháng thể nóng hay lạnh với độ chuyên biệt không xác định.
Theo khuyến cáo:
Trước khi thực hiện biện pháp truyền máu cho bệnh nhân, nên xác định thêm các kháng nguyên hồng cầu như là các kháng nguyên C, c, E, e và Kell để hỗ trợ định danh các kháng thể trong trường hợp xuất hiện phản ứng miễn dịch muộn về sau;
Đối với tất cả các bệnh nhân bị Thalassemia nên được truyền máu phù hợp kháng nguyên ABO và Rh (D).
Thêm vào đó, việc sử dụng máu phù hợp kháng nguyên C, E và Kell rất được khuyến cáo để tránh phản ứng kháng thể bất thường chống lại các kháng nguyên này. Vài trung tâm thậm chí còn sử dụng máu phù hợp với nhiều kháng nguyên hơn trên.
Trước mỗi lần truyền máu cần thiết phải thực hiện phản ứng chéo và tầm soát các kháng thể mới.
Nếu các kháng thể mới xuất hiện, cần phải được xác định để tránh truyền máu có kháng nguyên tương ứng. Nên lập phiếu theo dõi đầy đủ và chi tiết về các kháng nguyên hồng cầu, kháng thể hồng cầu và các phản ứng truyền máu cho mỗi bệnh nhân, và phiếu này cần sẵn có bên cạnh bệnh nhân nếu bệnh nhân được truyền máu ở một trung tâm khác. Việc truyền máu từ người cho đồng huyết thống nên tránh vì nguy cơ hình thành kháng thể có thể ảnh hưởng tới kết quả ghép tế bào gốc sau này.
QUI TRÌNH TRUYỀN MÁU
Khuyến cáo điều trị bệnh nhân thalassemia thể nặng có liên quan tới vấn đề truyền máu thường xuyên và suốt đời, và thường truyền mỗi 2 đến 5 tuần để duy trì mức hemoglobin trên 9-10,5 g/dl.
Cách truyền máu này giúp cho sự phát triển bình thường, cho phép thực hiện các hoạt động thể chất một cách bình thường, đủ để ức chế các hoạt động tủy xương ở hầu hết các bệnh nhân và giảm thiểu sự tích tụ sắt do truyền máu (Cazzola, 1995 và 1997). Mức hemoglobin (Hb) cao hơn từ 11-12 g/ dl thích hợp đối với bệnh nhân có bệnh tim hoặc những bệnh nội khoa khác và dành cho những bệnh nhân không đạt được sự ức chế tủy xương ở mức hemoglobin thấp hơn. Mặc dù khoảng cách giữa các lần truyền máu ngắn đi sẽ làm giảm bớt nhu cầu truyền máu, sự lựa chọn khoảng cách này cũng phải xem xét đến các yếu tố khác như là công việc, thời khóa biểu sinh hoạt và thói quen sống của bệnh nhân.
Quyết định bắt đầu điều trị truyền máu suốt đời nên dựa vào một chẩn đoán xác định β-thalassemia đồng hợp tử. Chẩn đoán này nên dựa trên xét nghiệm sinh học phân tử, mức độ thiếu máu nặng lặp lại nhiều lần, sự tạo máu không hiệu quả và các tiêu chuẩn lâm sàng như chậm tăng trưởng hoặc biến dạng xương. Việc bắt đầu truyền máu đối với bệnh nhân thalassemia thể nặng thường xảy ra trong 2 năm đầu đời. Một số bệnh nhân thalassemia thể nhẹ chỉ cần vài đợt truyền máu trong 20 năm đầu nhưng sau đó có thể cần truyền máu thường xuyên hơn do giảm lượng hemoglobin hoặc sự gia tăng các biến chứng nặng (xem Chương 11: Thalassemia thể trung gian và HbE). Nguy cơ của phản ứng do kháng thể bất thường do truyền máu dường như cao hơn ở bệnh nhân bắt đầu truyền máu sau vài năm đầu đời (Michail-Merianou, 1987; Spanos, 1990; xem Bảng 3). Chẳng hạn như sự hiện diện của kháng thể bất thường và tự kháng thể (xem bên dưới) có thể ảnh hưởng nghiêm trọng đến việc truyền máu ở những bệnh nhân thalassemia thể trung gian là những đối tượng được truyền máu lần đầu tiên ở độ tuổi thanh niên trở lên.
Các khuyến cáo về lưu ý đến thể tích máu truyền thì rất khó do việc sử dụng những chất kháng đông để bảo quản và dung dịch treo bổ sung khác nhau. Đối với đơn vị máu sử dụng kháng đông CPD-A có dung tích hồng cầu (Hct) khoảng 75%, thể tích máu mỗi lần truyền thường là 10-15ml/ kg trong 3-4 giờ. Những đơn vị máu dùng các dung dịch treo bổ sung có thể có Hct thấp hơn trong khoảng 60-70%, và do đó cần một thể tích lớn hơn với lượng Hct được yêu cầu cao hơn để có thể cung cấp cùng một khối lượng hồng cầu như đối với đơn vị máu CPD-A (xem Bảng 4). Đối với hầu hết bệnh nhân, có thể dễ dàng tránh được những khác biệt của nồng độ hồng cầu như vậy bằng cách đăng ký số đơn vị máu cố định (thí dụ như một hoặc hai đơn vị) hơn là đăng ký khối lượng máu đặc biệt. Trẻ nhỏ có thể chỉ cần một phần của túi máu để tránh việc quá mức hay dưới mức nhu cầu truyền máu. Đối với bệnh nhân suy tim hoặc có lượng hemoglobin lúc đầu quá thấp nên nhận những số lượng hồng cầu ít hơn với tốc độ truyền chậm hơn.
Tỉ lệ xảy ra phản ứng miễn dịch do kháng thể bất thường theo tuổi được bắt đầu truyền máu
|
< 1 tuổi |
7,7% |
|
> 1 tuổi |
27,9% [Machail-Merianou và cs., 1987] |
Tỉ lệ xảy ra phản ứng miễn dịch do kháng thể bất thường theo tuổi được bắt đầu truyền máu
|
< 3 tuổi |
20,9% |
|
> 3 tuổi |
47,5% [Spanos và cs., 1990] |
Bảng 3: Độ tuổi và phản ứng miễn dịch do kháng thể bất thường ở bệnh nhân thalassemia
|
Mức Hb cần tăng |
Hct của hồng cầu người cho |
||||
|
|
50% |
60% |
75% |
80% |
|
|
1 g/dl |
4.2 ml/kg |
3.5 ml/kg |
2.8 ml/kg |
2.6 ml/kg |
|
|
2 g/dl |
8.4 ml/kg |
7.0 ml/kg |
5.6 ml/kg |
5.2 ml/kg |
|
|
3 g/dl |
12.6 ml/kg |
10.5 ml/kg |
8.4 ml/kg |
7.8 ml/kg |
|
|
4 g/dl |
16.8 ml/kg |
14.0 ml/kg |
11.2 ml/kg |
10.4 ml/kg |
|
Trong ví dụ này, để tăng mức Hb lên 4 g/dl ở bệnh nhân cân nặng 40 kg và sử dụng máu AS-1 với lượng Hct 60% thì cần 560 ml. Cách tính toán này được áp dụng đối với người có thể tích máu 70 ml/kg.
Bảng 4: Hướng dẫn cách tính lượng máu để truyền
Hb sau truyền không nên lớn hơn 14-15 g/dl và nên thỉnh thoảng được kiểm tra để đánh giá mức tụt Hb giữa các lần truyền máu trong việc lượng giá hiệu quả của những thay đổi của chế độ truyền máu, mức độ cường lách, hay những thay đổi trong đáp ứng với truyền máu mà không giải thích được.
Mặc dù chiết tách hồng cầu, hay truyền thay máu bằng máy tự động, đã cho thấy giảm nhu cầu truyền máu và giảm ứ sắt do truyền máu (Berdoukas, 1986; Friedman, 2003), phương pháp này bị giới hạn do làm tăng sử dụng máu người cho gấp 2 đến 3 lần, tăng (i) giá thành, (ii) nguy cơ nhiễm trùng và (iii) hình thành phản ứng miễn dịch do kháng thể bất thường.
Nên lập phiếu theo dõi truyền máu cẩn thận cho mỗi bệnh nhân, bao gồm thể tích hay trọng lượng của những đơn vị máu đưa vào, Hct của các đơn vị máu hay Hct trung bình của các đơn vị với những dung dịch bảo quản chống đông tương tự, các chất bảo quản có kháng đông và cân nặng của bệnh nhân. Với những thông tin này, có thể tính được lượng máu cần mỗi năm cũng như thể tích máu được truyền và hồng cầu nguyên chất (Hct 100%) trên mỗi kg của cân nặng cơ thể.
Khi nhân thể tích hồng cầu nguyên chất cho 1,08, lượng sắt ước tính trên mỗi 1 ml hồng cầu tinh khiết (xem Chương 3: Ứ Sắt và Điều Trị Thải Sắt) cho một giá trị tương đương với lượng sắt do truyền máu mà bệnh nhân nhận được trên mỗi kg trọng lượng cơ thể trong 1 năm. Hình 1 cho thấy ví dụ chi tiết về cách tính tỉ lệ ứ sắt mỗi ngày (mg/kg/ngày) và Bảng 5 cho thấy mối liên quan giữa nhu cầu truyền máu hàng năm với tỉ lệ ứ sắt mỗi ngày ở hai mức Hct thường gặp của máu người cho. Tỉ lệ ứ sắt do truyền máu có thể rất quan trọng khi lựa chọn liều thích hợp của thuốc thải sắt. Ví dụ, liều khuyến cáo của thuốc thải sắt deferasirox dựa trên tỉ lệ ứ sắt do truyền máu mỗi ngày hay hàng năm.
|
Cân nặng bệnh nhân: 40 kg Lượng máu truyền: 600 ml mỗi 4 tuần. Hct trung bình của hồng cầu truyền: 60% Nhu cầu máu hàng năm: 13 đợt truyền x 600 ml/40 kg = 195 ml/kg Nhu cầu truyền hồng cầu nguyên chất hằng năm: 195 ml/kg/năm x 60% (hematocrit trung bình) = 117 ml/kg/năm Lượng sắt ứ hàng năm do truyền máu: 117 ml/kg/năm hồng cầu nguyên chất x 1,08 mg sắt trong 1 ml hồng cầu nguyên chất = 126 mg sắt Lượng sắt ứ mỗi ngày do truyền máu: 126 mg sắt/năm/365 ngày = 0,34 mg/kg |
Hình 1: Cách tính nhu cầu truyền máu và lượng sắt ứ hàng năm do truyền máu.
|
Nhu cầu máu hàng năm (Hematocrit 60%) |
Nhu cầu máu hàng năm (Hematocrit 75%) |
Nhu cầu máu hàng năm (Hematocrit 100%) |
Lượng sắt ứ trung bình mỗi ngày |
|
100 – 150 ml/kg |
80 – 120 ml/kg |
60 – 90 ml/kg |
0.18 – 0.27 mg/kg |
|
150 – 200 ml/kg |
120 – 160 ml/kg |
90 – 120 ml/kg |
0.27 – 0.36 mg/kg |
|
200 – 250 ml/kg |
160 – 200 ml/kg |
120 – 150 ml/kg |
0.36 – 0.44 mg/kg |
|
250 – 300 ml/kg |
200 – 240 ml/kg |
150 – 180 ml/kg |
0.44 – 0.53 mg/kg |
Bảng 5: Mối liên hệ giữa nhu cầu truyền máu mỗi năm với tỉ lệ ứ sắt mỗi ngày.
Biết được nhu cầu truyền máu hằng năm rất có giá trị để xác định những biến cố góp phần chứng minh quan trọng gây cường lách hoặc sự tăng phá hủy hồng cầu người cho.
Xây dựng phác đồ chuyên biệt về cắt lách khi bệnh nhân đang có nhu cầu truyền máu gia tăng thì rất khó khăn vì không ghi lại được nồng độ trung bình của dung tích hồng cầu của các đơn vị truyền máu trước đó, và cũng không ghi nhận được một cách chắc chắn kết quả theo dõi lâu dài sau cắt lách các biến chứng thường gặp như nhiễm trùng và huyết khối. Hơn nữa khi tiến tới quyết định cắt lách cần xem lại khả năng cá nhân về kiểm soát lượng sắt dự trữ dựa trên lượng sắt đưa vào cơ thể do truyền máu trước đó. Tuy nhiên, khi nhu cầu truyền máu vượt quá 200 ml hồng cầu nguyên chất mỗi năm, việc cắt lách nên được tính đến như là một chiến lược để làm giảm tỉ lệ ứ sắt.
Xem tiếp: Liệu pháp truyền máu trong bệnh β-Thalassemia thể nặng (P3)
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









