️ BK virus đo tải lượng Real-time PCR
MỤC ĐÍCH VÀ NGUYÊN LÝ
Mục đích:
Phát hiện và đo số bản sao của virus BK trong dịch não tủy, huyết tương, máu toàn phần hoặc nước tiểu của người.
Nguyên lý:
Dựa trên nguyên lý kỹ thuật Real - time PCR.
CHUẨN BỊ
Người thực hiện:
Người thực hiện: Nhân viên xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành vi sinh (và / hoặc sinh học phân tử / sinh học / công nghệ sinh học).
Người nhận định và phê duyệt kết quả: Người thực hiện có trình độ đại học hoặc sau đại học về chuyên ngành vi sinh (và / hoặc sinh học phân tử / sinh học / công nghệ sinh học).
Phương tiện, hóa chất:
Trang thiết bị:
Máy Real - time PCR và hệ thống máy vi tính.
Máy tách chiết acid nucleic.
Bộ lưu điện.
Máy ủ nhiệt.
Máy ly tâm dùng cho tube 0,2 ml
Máy ly tâm lạnh > 12000 gpm / phút.
Tủ lạnh 2oC -8oC.
Tủ âm sâu (-20oC) hoặc (-70oC) (nếu có).
Máy vortex.
Tủ an toàn sinh học .
Micropipettes các thể tích từ 0,5 µl - 1000 µl.
Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm):
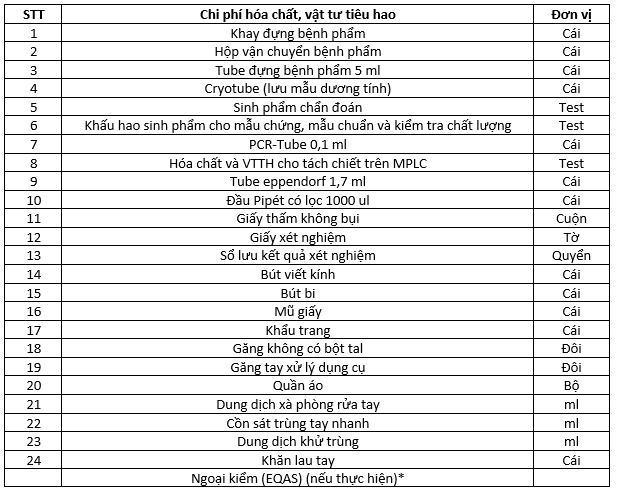
Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần / 1 năm).
Bệnh phẩm:
Dịch não tủy, huyết tương, máu toàn phần và nước tiểu.
Phiếu xét nghiệm:
Điền đầy đủ thông tin theo mẫu yêu cầu.
CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
Lấy bệnh phẩm:
Theo đúng quy định của chuyên ngành vi sinh.
Tiến hành kỹ thuật:
BK virus PCR Kit (GeneProof – VD hoặc tương đương).
Thu nhận và xử lí mẫu:
Phải đồng nhất và xử lý mẫu trước khi tách chiết DNA nếu cần.
Tách chiết DNA:
Tách chiết bằng tay hoặc máy tự động.
Thực hiện phản ứng real-time PCR.
Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
Bật máy real-time PCR. Bật máy tính khởi động chương trình real-time PCR trước khi chạy mẫu ít nhất 15 phút.
Pha hóa chất:
Chuẩn bị đủ số tube PCR cần dùng.
Cho 30 µl MasterMix vào mỗi tube.
Nhỏ 10 µl mẫu DNA đã tách chiết từ bệnh phẩm hoặc mẫu chứng dương (gồm 4 nồng độ từ 101 đến 104), chứng âm vào các tube tương ứng. Tổng thể tích cuối cùng là 40 µl.
Ly tâm nhẹ ống rồi đặt vào máy real-time PCR theo vị trí đã cài đặt.
Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
Chọn màu FAM cho mẫu, chứng dương và chứng âm và HEX cho chứng nội.
Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động.
Lưu file dữ liệu vào máy tính.
Cho máy real-time PCR chạy chương trình.
NHẬN ĐỊNH KẾT QUẢ
Điều kiện của phản ứng:
Giá trị định lượng chấp nhận được nếu cả 3 chứng: Chứng âm, chứng dương và chứng nội có nghĩa. Các chứng có giá như sau:
Chứng âm: Không phát hiện.
Chứng dương: Nằm trong khoảng cho phép của nhà sản xuất (đặc hiệu với từng lô thuốc thử).
Chứng nội: Với chứng âm và mẫu không phát hiện phải có tín hiệu lên ứng với Ct < 38.
Ngược lại:
Chứng âm: Nếu chứng âm không hợp lệ thì phải thực hiện lại xét nghiệm cả chứng và toàn bộ lô bệnh phẩm.
Chứng dương: Nếu chứng dương không hợp lệ thì phải làm lại xét nghiệm toàn bộ mẻ chạy.
Chứng nội: Không có tín hiệu lên với chứng âm và mẫu không phát hiện với Ct < 38 thì phải chạy lại mẫu đó.
Phân tích mẫu:
Đo tải lượng virus (VL) được tính toán sử dụng công thức sau: VL(copies / ml) = (SC x EV) / IV.
Trong đó:
VL = giá trị định lượng (copies/ml).
SC = nồng độ trong mẫu (sample concentration – cp / µl) .
EV = thể tích thu mẫu (elution volume - µl).
IV = thể tích tách chiết (isolation volume - ml) .
NHỮNG SAI SÓT VÀ XỬ TRÍ
Sự cố:
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
Nguyên nhân:
Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
Khắc phục:
Pha loãng mẫu từ 10 - 100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu.
Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh
.png)


.png)





