️ Ứ sắt (P2)
THEO DÕI TÌNH TRẠNG Ứ SẮT
Theo dõi chặt chẽ và đánh giá càng chính xác càng tốt tình trạng ứ sắt là cần thiết trong việc xây dựng chế độ thải sắt hiệu quả, chẳng hạn như những điều đề cập trong chương này, phù hợp với nhu cầu của từng bệnh nhân cụ thể. Tuy nhiên, một số nguyên tắc chung trong theo dõi tình trạng ứ sắt áp dụng cho tất cả phương pháp điều trị:
Ferritin huyết thanh
Đây là một xét nghiệm tương đối dễ thực hiện, dễ thiết kế, ferritin có tương quan tới sắt dự trữ trong cơ thể và tiên lượng bệnh ở bệnh nhân thalassemia thể nặng.Khi ferritin huyết thanh lên đến 3000 μg/L, ferritin được bài tiết từ các đại thực bào dưới dạng sắt tự do, nhưng trên ngưỡng này sẽ tăng tỉ lệ sắt dạng ferritin “rò rỉ” từ các tế bào gan (Worwood, 1980; Davis, 2004). Sự dao động ferritin từng ngày, được ghi nhận đặc biệt trong các trường hợp: tăng sự vận chuyển sắt, viêm nhiễm, viêm gan, và hoặc tổn thương gan có thể làm tăng giả ferritin trong khi sự thiếu hụt vitamin C gây giảm ferritin. Khi ferritin tăng đột ngột và bất ngờ cần chú ý tìm nguyên nhân như viêm gan, nhiễm trùng khác hoặc tình trạng viêm nhiễm. Trong thalassemia thể trung gian, ferritin huyết thanh thường cho kết quả thấp hơn mức độ ứ sắt thật sự. (Pootrakul 1981). Do đó mặc dù có sự tương quan chung giữa ferritin huyết thanh và sắt ở gan, sự dự đoán ứ sắt dựa trên ferritin huyết thanh có thể không đáng tin cậy Olivieri 1995). Tuy nhiên, điều quan trọng là có ít nhất năm nghiên cứu đã cho thấy một sự liên quan giữa kiểm soát ferritin huyết thanh và tiên lượng (Gabutti V và Piga A. 1996; Olivieri, N. và cs. 1994; Telfer PTl, 2000; BA Davis, và cs. 2004; Borgna-Pignatti, 2004). Các nghiên cứu cho thấy nguy cơ của bệnh tim và tử vong thấp hơn đáng kể ít nhất 2/3 trường hợp khi mức ferritin huyết thanh được duy trì trong khoảng thời gian từ 10 năm trở lên ở mức dưới 2500 μg/L (với desferrioxamine) (Olivieri, 1994). Quan sát với số bệnh nhân lớn hơn cho thấy thậm chí duy trì ferritin huyết thanh thấp hơn 1000 μg/L có thể có nhiều kết quả có lợi nữa (Borgna-Pignatti, 2004) (Xem Bảng 2).
Nồng độ sắt trong gan (LIC)
Nồng độ sắt trong gan hiện nay được coi là tiêu chuẩn tham khảo để ước tính lượng sắt trong cơ thể và đã được chứng minh dự đoán chính xác toàn bộ sắt dự trữ (Angelucci, 2.000), sử dụng công thức:
![]()
Giá trị nồng độ sắt trong gan bình thường lên đến 1,8 mg/g trọng lượng khô và có thể lên đến 7 mg/g trọng lượng khô thấy trong một số quần thể không bệnh thalassemia mà không có ảnh hưởng xấu (Xem Hình 2).
Một số nghiên cứu cho thấy có mối liên hệ giữa nồng độ sắt trong gan cao (trên 15-20 mg/g trọng lượng khô) với tiên lượng xấu (Brittenham năm 1993; Telfer, 2000), tiến triển đến xơ gan (Angelucci, 1997) hoặc bất thường chức năng gan (Jensen, 2003).

Nếu không điều trị thải sắt trước, nguy cơ ứ sắt ở cơ tim tăng với số lượng đơn vị máu truyền (Buja và Roberts, 1971; Jensen, 2003). Tuy nhiên, các nghiên cứu gần đây xác định có sự không đồng điệu giữa ứ sắt ở gan và tim trong một số bệnh nhân được thải sắt: bệnh nhân tăng ứ sắt ở gan có thể có dự trữ sắt ở tim bình thường, trong khi bệnh nhân có sắt ở gan bình thường hoặc gần bình thường có thể bị ứ sắt ở tim. Trong khi sự kiểm soát sắt của cơ thể qua nhiều năm là quan trọng để tiên lượng, nồng độ sắt ở gan không quan trọng bằng nồng độ sắt ở tim trong xác định nguy cơ trực tiếp gây suy tim. Do đó, mặc dù kiểm soát lâu dài sắt của cơ thể là quan trọng để tiên lượng, nguy cơ tổn thương một cơ quan đặc biệt như gan hoặc tim ở tại một thời điểm bất kỳ được đánh giá tốt nhất bằng cách đo sắt trong các chính cơ quan cần khảo sát.
Xác định nồng độ sắt trong gan cần được kiểm tra bởi các bác sĩ điều trị cho những bệnh nhân có mức ferritin huyết thanh không giống dự kiến (tức là những người nghi ngờ có phối hợp bệnh viêm gan, hoặc bệnh nhân với chế độ điều trị thải sắt mà đáp ứng thay đổi hoặc không xác định), vì điều này có thể làm giảm nguy cơ điều trị thải sắt không đủ liều hoặc quá liều. Vì mối liên hệ giữa ferritin huyết thanh với tình trạng ứ sắt và cân bằng sắt chưa được xác định, đánh giá nồng độ sắt trong gan đặc biệt có ích khi áp dụng một liệu trình thải sắt mới được áp dụng.
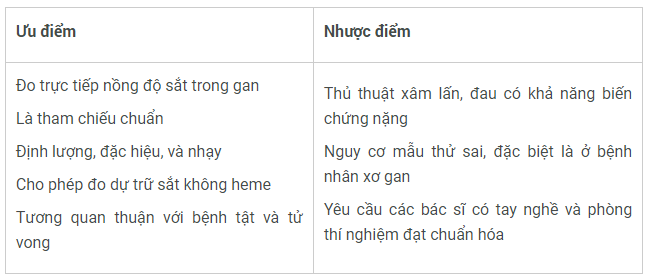
Đo nồng độ sắt trong gan có thể được thực hiện bằng hóa chất trên một mẫu sinh thiết gan (tươi, cố định hoặc làm tan khỏi chất cố định paraffine) (xem Bảng 3) hoặc bằng các phương pháp không xâm lấn như magnetic biosusceptometry (SQUID) (Brittenham, 1993) hoặc hình ảnh cộng hưởng từ (MRI) (xem Bảng 4). Sinh thiết là một thủ thuật xâm lấn nhưng với người có kinh nghiệm thực hiện thì tỉ lệ biến chứng thấp (Angelucci 1997). Mẫu sinh thiết không đủ kích thước (<1 mg/g trọng lượng khô, 4 mg trọng lượng ướt hoặc chiều dài dưới 2,5 cm) hoặc phân bố sắt không đồng đều, đặc biệt là trong xơ gan (Villeneuve 1996) có thể cho kết quả sai lệch.
Nồng độ sắt trong gan cũng có thể đo chính xác bằng cách sử dụng một phương pháp được gọi là SQUID (supercoducting quantum interference device). Tuy nhiên, chỉ có bốn máy như vậy hiện nay trên toàn thế giới: nó quá đắt để mua, bảo quản và cần đào tạo người sử dụng. Đo nồng độ sắt trong gan bằng SQUID có lợi thế là có phạm vi tương quan tuyến tính rộng nhưng mỗi máy SQUID phải được đọc riêng.
Ngày nay nồng độ sắt trong gan cũng có thể được đo bằng kỹ thuật MRI mà trước đây bị giới hạn do phạm vi tương quan tuyến tính tương đối hẹp. Một phương pháp được mô tả gần đây là R2 hoặc kỹ thuật Ferriscan cho kết quả tương quan tuyến tính có thể chấp nhận và kết quả có thể lặp lại có khả năng áp dụng trên lâm sàng (St Pierre TG, và cs., 2005). Các kỹ thuật cho thấy độ nhạy trung bình trên 85%, độ đặc hiệu trên 92% với khả năng cho phép đánh giá nồng độ sắt trong gan lên đến 15 mg/g trọng lượng khô và đã được đăng ký tại Châu Âu và Hoa Kỳ. Để đọc kết quả, các máy MRI phải sử dụng một Phantom cung cấp bởi các công ty, trong khi dữ liệu thu thập được gửi thông qua internet để phân tích bằng phần mềm chuyên dụng Ferriscan (trả tiền cho mỗi lần phân tích). Một lợi thế đặc biệt của kỹ thuật này là nó có thể được áp dụng mà không cần đào tạo nhiều tại bất kỳ trung tâm nào với một máy MRI tương đối hiện đại (xem Bảng 4).
Chức năng tim
Theo dõi thường xuyên phân suất tống máu thất trái (LVEF) cho phép xác định một nhóm bệnh nhân tiên lượng xấu có nguy cơ suy tim và tử vong cao, nhưng có khả năng đáp ứng tốt với điều trị tăng cường desferrioxamine (Davis và cs., 2004). Bệnh nhân với phân suất tống máu đo thấp hơn giá trị tham chiếu có nguy cơ suy tim và tử vong tăng 35 lần, với khoảng thời gian trung vị tiến triển đến suy tim 3,5 năm cho phép thời gian để tăng cường điều trị thải sắt. Chức năng thất trái có thể xác định bằng cách sử dụng MRI, MUGA hoặc siêu âm tim. Hai phương pháp đầu tiên có lợi thế hơn siêu âm tim do ít phụ thuộc vào người thực hiện do đó dễ theo dõi xuyên suốt.
Bảng 3: Đo nồng độ sắt trong gan bằng sinh thiết gan
Ước tính sắt ở cơ tim (T2* hay các biện pháp đo khác) Sử dụng MRI ước tính sắt ở cơ tim ngày càng tăng nhưng đòi hỏi chuyên môn trong việc sử dụng và chuẩn hóa của nó. Giá trị T2* trong các mô ngắn lại khi nồng độ sắt tăng lên. T2* của cơ tim ngắn < 20 ms (chứng tỏ tăng sắt ở cơ tim) liên quan với khả năng giảm chức năng thất trái tăng (Anderson và cs., 2001). Ví dụ, bệnh nhân có giá trị T2* > 20 ms ít có nguy cơ giảm LVEF.
Giá trị T2* 10-20 ms thì chỉ có 10% khả năng giảm LVEF; từ 8-10 ms thì có 18% khả năng giảm LVEF; 6 ms có 38% khả năng giảm LVEF; và giá trị T2* 4 ms thì có đến 70% khả năng giảm LVEF (Westwood, 2007). Tại các trung tâm có sẵn phương pháp đo, giá trị T2*có thể xác định bệnh nhân có nguy cơ cao giảm LVEF trước khi nó xảy ra và cho phép có nhiều thông tin để lựa chọn bệnh nhân nào cần áp dụng liệu pháp thải sắt tích cực.
Ước lượng sắt ở tim cung cấp thêm một cách để phân tầng rủi ro, mở ra một cách chẩn đoán mới. Tuy nhiên, các yếu tố ảnh hưởng đến nguy cơ phát triển suy tim do ứ sắt ở cơ tim rất phức tạp, trong khi biện pháp đo trữ sắt T2* không đo trực tiếp độc tính đối với tế bào. Các yếu tố có thể làm tăng lượng sắt nội bào tự do, gây tổn thương nội bào như viêm cơ tim, hoặc thải sắt thiếu liên tục, có thể ảnh hưởng đến nguy cơ gây ra do ứ sắt quá mức ở tim, và giải thích tại sao chỉ có một tỉ lệ bệnh nhân với giá trị T2* ngắn biểu hiện bất thường chức năng tim khi đo ở ở bất cứ thời điểm nào. Dữ liệu tiên đoán liên quan giữa T2* cơ tim và khả năng sống còn vẫn cần chứng minh. Tuy nhiên, mối liên quan giữa giá trị T2* ngắn (<10ms) và nguy cơ rối loạn chức năng tim là rõ ràng (xem Bảng 5).
Bảng 4: MRI đánh giá nồng độ sắt ở gan

Đánh giá sắt ở nước tiểu
Đo sự bài tiết sắt qua nước tiểu có thể giúp đánh giá hiệu quả bài tiết sắt của desferrioxamine (khoảng một nửa tổng số sắt bài tiết trong nước tiểu) hoặc deferiprone (trên 80% sắt bài tiết trong nước tiểu). Tuy nhiên, sự biến đổi trong bài tiết sắt hàng ngày đòi hỏi phải xác định lặp lại nhiều lần. Ngoài thải qua đường tiểu, bài tiết sắt qua phân cũng góp phần trong việc thải sắt nhưng ở kết quả thường dao động (30 -100% tổng số sắt bài tiết) tùy thuộc vào mức độ dự trữ sắt, liều desferrioxamine và mức độ hemoglobin (Pippard 1982).
Sắt không kết hợp transferrin trong huyết tương (NTBI)
Chất chuyên chở bình thường của sắt trong huyết tương là transferrin sẽ trở nên bão hòa khi ứ sắt và phần sắt còn lại không được kết hợp được gọi là sắt không kết hợp transferrin (hoặc NTBI).
NTBI sẽ bị đào thải bởi nhiều tế bào khác nhau và chịu trách nhiệm chính của tình trạng phân phối sắt bất thường trong ứ sắt do truyền máu. Bởi vì dạng sắt này nhanh chóng xuất hiện trở lại sau khi thuốc thải sắt đã đào thải, các chuyên gia khuyến cáo thải sắt liên tục 24 giờ là cách điều trị tối ưu (Porter, 1996).
NTBI bao gồm một số chất hóa học, chỉ một số trong đó có thể thải dễ dàng và chỉ một số có thể tham gia chu trình oxy hóa khử. Một cách để đo lường thành phần NTBI không bền có khả năng tham gia chu trình oxy hóa khử là xét nghiệm sắt không bền trong huyết tương (xét nghiệm LPI). Tuy nhiên, mặc dù đo NTBI (hoặc LPI) đã được chứng minh là một phương pháp hữu ích kiểm tra tương tác giữa thuốc thải sắt và lượng sắt huyết tương, giá trị của phương pháp này như một hướng dẫn đối với điều trị thường quy hay tiên lượng vẫn chưa được xác định.
Các dấu hiệu của sự tổn thương do oxy hóa
Một loạt các dấu hiệu của sự tổn thương do oxy hóa đã được nghiên cứu. Malondialdehyde (MDA) tăng trong ứ sắt, trong khi một loạt các chất chống oxy hóa bị giảm.
Sử dụng các chất chống oxy hóa hoặc các sản phẩm tự nhiên có đặc tính chống oxy hóa, như Curcumin thu hút sự quan tâm nghiên cứu. Tuy nhiên, nên thận trọng trong sử dụng các chất này cho đến khi nào có kết quả nghiên cứu dựa trên dữ liệu có chứng cớ vì tác động của chất chống oxy hóa dưới sự hiện diện của sắt có thể không tiên đoán trước được do chu trình oxy hóa khử giữa sắt (II) và sắt (III).
Các dấu hiệu của rối loạn chức năng cơ quan.
Phần này được thảo luận nhiều hơn trong những chương khác. Tuy nhiên, bệnh nhân ứ sắt nên được theo dõi để tìm bằng chứng của suy sinh dục do giảm hormon hướng dục (tăng trưởng, phát triển khả năng tình dục và những dấu hiệu khác của suy sinh dục do giảm hormon hướng dục), bệnh tiểu đường (thử nghiệm bất dung nạp glucose hàng năm), suy giáp và suy tuyến cận giáp.
Xem tiếp: Ứ sắt (P3)
Bệnh viện Nguyễn Tri Phương - Đa khoa Hạng I Thành phố Hồ Chí Minh









